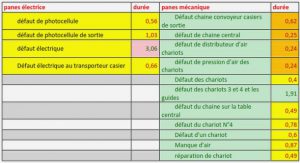
Corrosion localisé
C’est une corrosion qui se déroule en lieu spécifiquement anodique d’une surface. Elle provient d’une hétérogénéité du matériau ou de l’environnement. Cette forme de corrosion se classe comme l’aspect le plus dangereux car l’attaque se fait en certains endroits de la surface du métal mais la perte de masse est relativement faible. Les principales causes de cet aspect de la corrosion peuvent être dues à des origines multiples tant au niveau du matériau qu’au niveau de l’environnement. [2][3] La corrosion localisée peut apparaître sous 9 formes :
La corrosion galvanique,
La corrosion par piqûres,
La corrosion par crevasses,
La corrosion intergranulaire,
La corrosion sous contrainte,
La fatigue corrosion,
La fragilisation par l’hydrogène,
La corrosion-érosion et la corrosion-cavitation,
La corrosion sélective.
La corrosion uniforme
C’est le processus de corrosion chimique qui se répartit dans toute la surface du métal avec une même vitesse de corrosion. A l’échelle macroscopique on ne distingue pas les lieux cathodiques des lieux anodiques ; la surface entière du métal est simultanément cathode et anode. Il y a donc corrosion uniforme (figure 7) si toute la surface du métal est attaquée de la même façon et s’il n’y a pas de circulation d’électron au sein du métal [2].
Formation des solutions électrolytique ou électrolyte
Une solution électrolytique (ou électrolyte) est une solution aqueuse conductrice ionique. Des sels solubles sont dissous dans la solution pour former des électrolytes dites faibles (conductivités faibles) ou forts (conductivité élevée) [14]. En solution, on appelle « solvant » l’espèce majoritaire et « soluté » les autres espèces. Un électrolyte est un mélange d’un soluté électrolytique dans un solvant. Deux groupes d’espèces ioniques sont présentes dans les bains électrolytiques :
– Les espèces électro-actives qui participent réellement à réaction (cas d’une électrolyse par exemple), et qui réagissent aux interfaces électrodes/électrolyte.
– Et d’autre part les espèces non électro-actives qui ne participent pas aux réactions d’interfaces, mais jouent toutefois un rôle dominant dans le transfert du courant au cœur de la solution.
Inhibiteur de corrosion
Définition : Un inhibiteur de corrosion est un additif chimique qui, ajouté à faible concentration au milieu corrosif, ralenti le processus de corrosion d’un métal placé au contact de ce milieu.
Propriétés : Un inhibiteur de corrosion doit [18] [19] :
abaisser la vitesse de corrosion du métal tout en conservant les caractéristiques physico-chimiques de ce dernier.
être non seulement stable en présence des autres constituants du milieu, mais également ne pas influencer sur la stabilité des espèces contenues dans ce milieu.
être utilisé en vue d’une protection permanente (surveillance primordiale du dispositif) ou plus couramment en vue d’une protection temporaire : durant une période où la pièce est particulièrement sensible à la corrosion (stockage, décapage, nettoyage…).
être compatible avec les normes de non toxicité.
être peu onéreux.
Un inhibiteur (ou mélange d’inhibiteurs) peut être combiné avec un autre moyen de protection supplémentaire d’un alliage à faible résistance à la corrosion, ou par addition à un revêtement de surface tel que la peinture.
Séchage et formation du film de peinture après dépôt
Après application, on doit attendre qu’un film solide se forme, ce laps de temps est le temps de séchage. Les propriétés de ce film dépendent du substrat (propreté, dégraissage…) ainsi que la composition de la peinture et de la méthode d’application utilisée. Le séchage d’une peinture sur un substrat se fait selon deux voies : physique ou chimique
Séchage physique : dans ce processus, aucune réaction chimique ne se produit. On le trouve dans le cas des peintures avec des liants à masse molaires élevées tels que les nitrates et les esters de cellulose, les polyacrylates, les polyesters thermoplastiques, les copolymères de styrène…. Avec ses polymères, la formation du film peut se faire à partir de solvants (organiques ou de dispersion dans des solvants organiques ou dans l’eau) qui s’évaporent en laissant le polymère sur le substrat. Ces liants confèrent au revêtement une bonne flexibilité et une bonne stabilité en raison de leur masse molaire élevée. Leur température de transition vitreuse doit être au dessus de la température ambiante pour assurer une bonne dureté et une bonne résistance à la rayure (scratch résistance) du film formé.
Séchage chimique : Ce type de processus concerne les peintures contenant les constituants du liant qui ont une masse molaire relativement faible, et qui réagissent entre eux au cours du séchage pour former des macromolécules réticulées par polymérisation : polyaddition ou polycondensation. Pour le séchage par polyaddition (résines époxy par exemple), la réaction peut se faire à température ambiante sans ajout de catalyseurs (autocatalytique) d’où la nécessité de mélanger rapidement les constituants du liant avant l’application de la peinture. Le temps au bout duquel la température est utilisable après la réalisation du mélange est limité et connu comme étant « la vie en pot » (pot life). Le séchage par polycondensation quant à lui, nécessite l’ajout de catalyseur, ou le travail à température élevée. Dans la plupart des cas, les deux phénomènes, physique et chimique, interviennent lors du séchage d’une peinture.
Les phénomènes de processus de décollement d’une peinture
Le processus de décollement sur un substrat de zinc, enduit par un polymère avec undéfaut de ce dernier (passif), était le résultat d’un couplage galvanique possible à la perméabilité élevée à l’oxygène. [30] L’oxygène pénètre jusqu’à l’interface métal/polymère par phénomène de diffusion (Loi de Fick). Celui-ci à son tour par réduction produit des ions hydroxyles OH- qui peuvent être concernés pour la formation des radicaux libres. Notons que dans cette interface, on parle de la réaction de réduction de l’oxygène qui est limité par la dissolution du métal (Zinc) qui est inhibé. [29] Sous le circuit ouvert, aucun courant n’est fourni au système, la réaction cathodique de réduction de l’oxygène sur l’interface AB est équilibrée par une réaction anodique sur la surface exposée en métal OA, avec un couplage galvanique étant développé entre les surfaces OA et AB. Quand une source de courant extérieure est imposée au système, la réaction cathodique de réduction de l’oxygène sur AB est équilibrée par une réaction anodique sur une contreélectrode située dans l’électrolyte. [31][35] Les phénomènes concernés dans le processus de décollement suivent une propagation en longueur. Ceci est représenté par le changement de la frontière BC à B’C ‘ comme représenté sur la figure 23. Ce changement de frontière se produit :
par la rupture simultanée des liens adhésifs
la dégradation de la peinture
la réduction de l’oxygène à l’interface métal/polymère
le transport des cations franchement chargés dans BB’C’C à ABCD comme le transport des ions négativement chargés de BB’C’C à ABCD.
En l’absence de l’oxygène, le décollement ne peut pas se propager et la réduction de l’oxygène à l’interface métal/polymère est négligeable par rapport au taux de réduction de l’oxygène dans la zone de défaut, donc le taux de corrosion dans cette zone augmentera légèrement. [5] Ces phénomènes sont issues des résultats des expériences associant la mesure du potentiel par un appareil nommé « Scanning Kelvin Probe », les test d’adhérences, les analyses chimiques par XPS (Spectromètre de photoélectrons X), la mise en épreuve dans un chambre climatique (chambre de corrosion) après la fabrication d’un défaut artificiel et en se basant sur les expérimentations de Leng sur le Fer enduit et celles de Stratmann et Furbeth sur les aciers galvanisés par un substrat de zinc pur associé à un revêtement passive (peinture). [35]
CONCLUSION
Le modèle simulant le décollement cathodique a été développé par un logiciel commercial nommé COMSOL Multiphysics. Un modèle 2D basé sur la loi Nernst-Planck pour calculer l’évolution du flux ionique dans l’électrolyte ainsi que sur la théorie Stratmann pour le système de décollement cathodique et la thèse de K. Allahar ont été utilisés pour simuler la cinétique dans la zone confinée de la peinture. La corrosion métallique qui affecte plusieurs entités dans le monde entier surtout dans la plupart de domaines industrielles est un phénomène de nature électrochimique résumé par le retour de ces matériaux à l’état de minerai. Plusieurs types de protections sont définis à titre bibliographique mais dans le cadre de cette étude on s’intéresse surtout sur le revêtement organique mince au nom de peinture. Dans le temps, des défauts naturels de ce revêtement passif mince peuvent être observés et causent des dégâts influant sur les propriétés mécanique, la liaison oxyde métallique/polymère et voire même le décollement de cette protection. Ces défauts peuvent être macroscopiques et conduisent à un processus de décollement susceptible d’endommager le métal. La réaction cathodique produit des ions qui contribuent à l’accélération du décollement du revêtement au voisinage du défaut. Tenant compte de l’énormité de ce problème, les chercheurs ont mis au point des essais visant à reproduire cette phénomène de façon accélérer; pour prévoir la durée de vie des peintures dans un environnement très agressif et connaître une formulation plus parfaite du problème. Reproduire les conditions réelles est difficile et beaucoup de phénomènes sont difficiles à observer pendant les analyses en laboratoire. Les simulations donnent des résultats plus pertinents. Le décollement progresse dans le temps vers la région du front ; des valeurs élevées du pH et de la porosité sont observées dans la région de délamination, et diminuent dans la région intact. Les paramètres de polarisation ont été considérés pour calculer les densités du courant dans la zone de décollement; on peut conclure qu’un courant nul signifie l’absence de décollement. Les dépôts provenant de l’électrolyte (pression partielle) de la zone de défaut et de décollement limitent la délamination, et peuvent conduire au décollement de la protection active en métal ou décollement anodique. Les réactions entre ces deux zones ne seraient plus possibles, les dépôts se posent sous une forme de blocage, la réaction de réduction de l’oxygène par diffusion ne serai plus possible à un temps t donné. Ce travail avait pour but initial de faire un pas concernant la compréhension du décollement des peintures à base époxy-amine sur un substrat métallique (Zinc). Outre, pour avoir un système adhérant, on doit tout d’abord bien formuler la peinture, la prise en compte du traitement de surface du projectile ne doit être oubliée, ensuite on doit bien vérifier que le système de protection soit bien appliquée et uniforme et enfin notons que plusieurs auteurs affirment que l’association de plusieurs revêtements est efficace pour protéger au mieux le métal. Soit par l’association de plusieurs revêtements minces (systèmes tri – couches) ou en ajoutant des revêtements épais comme celle à base de polyoléfines et les polyéthylènes mais ces derniers sont utilisés parfois dans les structures enterrés. Elles ne sont utilisées pour la protection extérieure pour une raison esthétique.
|
Table des matières
Remerciements
Abréviations
Grandeurs physiques
Liste des figures
Liste des tableaux
Introduction générale
Chapitre I Les éléments de la corrosion
I.1. Introduction
I.2. Corrosion des Métaux
I.2.1. Définition
I.2.2. Phénomène de corrosion
I.2.3. Les différents processus de la corrosion métallique
I.2.4. Les différents types d’oxydes issus lors de la corrosion de l’acier
I.3. Corrosion aqueuse
I.3.1. Phénomène de corrosion aqueuse
I.3.2. Les différentes formes de corrosion aqueuse
I.4. Réaction électrochimique
I.4.1 Notion d’électrode
I.4.2 Formation des solutions électrolytique ou électrolyte
I.4.3 Caractéristique d’une réaction électrochimique
I.5. Prévisions électrochimiques de la corrosion des métaux
I.5.1. Aspect thermodynamique
I.5.2. Aspect cinétique de la corrosion
I.6. Flux de la matière : Cas général
I.7. Densité de courant électrique dans le solution électrolytique
I.8. Bilan de conservation des espèces
I.9. Conclusion
Chapitre II Protection anti-corrosion
II.1 .Introduction
II.2 Les revêtements métalliques
II.2.1 Les Revêtements cathodiques
II.2.2 Les Revêtements anodiques
II.3 Inhibiteur de corrosion
II.3.1 Définition
II.3.2 Propriétés
II.4 Les revêtements organiques
II.4.1 Les bitumes
II.4.2 Les revêtements polymériques
II.4.3 Les peintures
Il existe deux types de base pour la couche primaire
II.4.4 Conclusion
Chapitre III: Présentation du modèle
III.1 Introduction
III.2 Les tests de corrosion
III.2.1 Type de test de corrosion
III.2.2 Essais cyclique
III.2.3 Essais au brouillard salin
III.3 Modèles
III.4 Modèle mécaniste
III.5 Développement du modèle
Chapitre IV: Modélisation et similation numérique
IV.1 Introduction
IV.2 Présentation du logiciel
IV.3 Procédure de Modélisation
IV.3.1 Créaction du modèle de simulation
IV.3.2 Créaction de la géométrie
IV.3.3 Maillage
IV.3.4 Insertion des conditions aux limites
IV.3.5 Les données d’entrées
IV.3.6 Simulation et traitement des résultats
Conclusion
Références bibliographiques
Annexe
Résumés
Télécharger le rapport complet