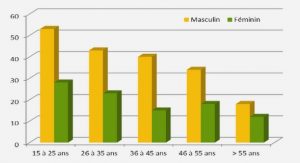
Production aquacole
Lors des trente dernières années, la production de poissons issue de l’aquaculture et destinée à l’alimentation humaine n’a cessé de se développer . Avec sa croissance mondiale annuelle de 8,6 %, de toutes les sources de protéines d’origine animale, l’aquaculture est le secteur qui a connu la plus forte progression (Allison 2011; FAO 2014).
De nos jours, la moitié de la consommation humaine de poissons provient de l’aquaculture (Troell et al. 2013; FAO 2014). Cet equilibre, entre production de poissons issus des produits de la pêche et ceux issus de l’aquaculture devrait prochainement disparaître. Effectivement, une augmentation de 35 % de la production aquacole est attendue d’ici les années 2022, contre 5 % pour les produits de la pêche. (Natale 2012; OECD/FAO 2013; Toufique and Belton 2014). Assurer une croissance de l’aquaculture apparaît comme l’unique moyen de répondre à la demande toujours plus forte de poissons (Lee and Yoo 2014). La consommation annuelle moyenne de poissons par habitant a en effet doublé lors des 50 dernières années, passant de presque 10 kg par habitant dans les années 1960 à presque 19 kg en 2010 (FAO 2014). Bien qu’elle soit mise en avant pour sa capacité à préserver les ressources marines, l’aquaculture n’en demeure pas moins dépendante des poissons issus de la pêche. Les poissons carnivores et omnivores ayant besoin de protéines et d’huiles de haute valeur nutritive pour leur croissance (Troell et al. 2014). Les harengs, sardines et maquereaux pêchés en mer et destinés à la production d’aliments pour poissons constituent la pêche minotière. Comme la pêche conventionnelle, la pêche minotière est elle aussi soumise à des quotas pour éviter l’épuisement des ressources marines. Dès lors, étant donné le plafonnement des pêches minotières et l’augmentation de la production aquacole, un déficit en farine de poissons destinée aux aliments aquacoles s’est installé depuis les années 1970.
Réglementation sur l’usage de protéines d’origine animale
Le déficit en farines de poisson, dû aux quotas imposés sur la pêche minotière, nécessite de nourrir les poissons carnivores et omnivores avec des ingrédients alternatifs.
Les protéines d’origine animale pourraient être utilisées en substitution, pourtant elles sont encore peu utilisées en aquaculture, notamment pour des raisons de réglementation. Cependant, la législation évolue et elles pourraient bientôt être incorporées dans les aliments pour poissons. Les sous-produits d’animaux étant des matières animales ou d’origine animale qui ne sont pas destinées à la consommation humaine. Parmi ces sous-produits, ceux de la catégorie 3 ne présentent aucun risque spécifique et regroupent des matières issues d’animaux sains, c’est-à-dire d’animaux issus de la chaine alimentaire conventionnelle, abattus à des fins d’alimentation humaine, mais dont certains morceaux ne sont pas consommés pour des raisons commerciales (morceaux non nobles, pieds d’animaux tels que les pieds de porc, aspect visuel, etc.). Il ne faut pas confondre les PAT avec les farines animales issues de cadavres d’animaux jugés impropres à la consommation alimentaire.
En 2013, le comité permanent de la chaîne alimentaire de la Commission Européenne a voté pour la réintroduction des PAT des non ruminants dans l’alimentation des animaux d’aquaculture. Les protéines hydrolysées d’insectes sont maintenant autorisées par la Commission Européenne, dans l’alimentation des animaux d’élevage. L’AESA (Autorité européenne de sécurité des aliments, EFSA) a émis un avis scientifique le 5 octobre 2015 sur les risques inhérents à l’utilisation des insectes dans l’alimentation animale (CNA 2011; DGAL 2016). Une liste d’insectes autorisés a été définie en alimentation animale. Celle-ci comprend actuellement la mouche soldat noire (Hermetia illucens), la mouche domestique (Musca domestica), le ténébrion meunier (Tenebrio molitor), le petit ténébrion mat (Alphitobius diaperinus), le grillon domestique (Acheta domesticus), le grillon domestique tropical (Gryllodes sigillatus), et le grillon des steppes (Gryllus assimilis). Il est donc possible que dans les années à venir, de la farine d’insectes soit incluse dans la formulation des aliments pour poissons carnivores.
Physiologie de la truite autour de la nutrition
Selon la nature de leur régime alimentaire, les poissons peuvent être classés comme détritivores, herbivores, omnivores, ou carnivores. Les espèces détrivores se nourrissent de débris animaux et de végétaux, les espèces herbivores se nourrissent exclusivement ou presque de plantes, les espèces omnivores se nourrissent à la fois d’aliments d’origine animale et végétale, tandis que les espèces carnivores, comme la truite arc-en-ciel, consomment de la chair ou des tissus d’animaux vivants ou morts. Au sein de chacune de ces catégories, si leur nourriture est très, modérément, ou peu variée, les poissons sont caractérisés respectivement comme euryphages, sténophages, ou monophages (Moyle 1982). Les espèces euryphages ont des régimes alimentaires variés, les espèces sténophages ont un régime alimentaire étroit et spécialisé, tandis que les espèces monophages ne se nourrissent que d’un seul type d’aliment, qu’il soit végétal ou animal. Les truites font parties des poissons euryphages, et acceptent donc des régimes alimentaires larges à base de
différents ingrédients. Cette caractéristique peut alors être exploitée lors des formulations alimentaires, en choisissant d’incorporer dans les rations pour truite différents ingrédients ayant un moindre impact environnemental. En effet les quotas imposés sur les produits de la pêche minotière implique de nourrir les truites avec des ingrédients différents de ceux qui étaient traditionnellement utilisés en aquaculture, à savoir la farine et l’huile de poisson, sous réserve que l’aliment proposé soit adapté aux besoins nutritionnels de la truite.
Principales étapes de la digestion de la truite
Phase stomacale
La phase de digestion gastrique constitue la première phase de la digestion des aliments avalés. Sa durée est plus ou moins longue suivant l’espèce de poisson, l’âge du poisson, la température des bassins et la nature de l’aliment distribué. Par exemple, sur des truites de 96 g nourries à hauteur de 3,4 % du poids vif, l’évacuation du contenu stomacal débute quatre heures après le repas, le quart des nutriments ingérés a été libéré dans l’intestin au bout de huit heures, et la totalité de l’estomac est vide au bout d’une journée (Windell and Norris 1969). Il a été constaté que la substitution de la farine de poisson par de la farine végétale allonge la durée de la phase gastrique chez la truite (Yamamoto et al. 1988).
La digestion des lipides et des protéines débutent dans la lumière de l’estomac via l’activité de la lipase gastrique et de la pepsine. La pepsine étant synthétisée sous forme de précurseur inactif, le pepsinogène, dans les cellules principales de l’estomac. La pepsine agit principalement sur les liaisons peptidiques engageant des acides aminés aromatiques ou des diacides (Márquez et al. 2013).
La digestion dans l’estomac n’assure pas seulement une émulsification et une hydrolyse des lipides en diglycérides, monoglycérides ainsi qu’en acides gras libres, elle provoque une cascade d’informations qui active le système digestif. L’arrivée dans le duodénum d’acides gras libres stimule le processus de sécrétion pancréatique. L’expression des enzymes de l’estomac peut également être régulée en fonction de l’efficacité de l’absorption intestinale des nutriments. Un processus de compensation se met par exemple en place chez les humains. Des patients, souffrant d’insuffisance pancréatique exocrine chronique, présentent en effet une augmentation d’un facteur de 3 à 4 de leur synthèse de lipase gastrique, comparés à des patients en bonne santé (Layer and Keller 2005). Chez les humains, la lipase gastrique montre une plus forte affinité pour la position sn-3 des triglycérides, contrairement à la lipase pancréatique qui a une affinité pour les liaisons sn-3 et sn-1. (Canaan et al. 1999) . L’estomac est également le principal organe d’absorption du calcium, du magnésium, du potassium, et du sodium qui se dissolvent à pH acide (Bucking and Wood 2007).
Sécrétion des enzymes pancréatiques
Le tissu pancréatique contribue à la synthèse d’enzymes et des bicarbonates qui seront ultérieurement sécrétés puis activés dans la lumière intestinale, en sortie d’estomac pour assurer le processus de digestion des aliments. A contrario des cellules pancréatiques endocrines, localisées sous le foie au niveau des corps de Brockmann (Jonsson 1991), les cellules pancréatiques exocrines de la truite, qui sont des cellules acineuses, ont la particularité d’être diffuses et localisées autour du foie et au sein du tissu adipeux entourant les caeca pyloriques (Sahlmann et al. 2015). Plusieurs petits canaux relient ces amas de tissus pancréatiques à la lumière digestive intestinale (Einarsson and Davies 1997). Les cellules acineuses pancréatiques synthétisent plusieurs proenzymes. Les protéases synthétisées comportent le trypsinogène, le chymotrypsinogène, l’élastase, la collagénase, des carboxypeptidases et des carboxylestérases. Les enzymes pancréatiques participent également à la digestion des glucides via l’α-amylase, à la digestion des lipides via la lipase pancréatique, l’estérase et la phospholipase, et à la digestion des acides nucléiques via la ribonucléase.
Facteurs limitant l’incorporation des ingrédients végétaux dans les aliments pour poisson
Profil en acides amines
Les protéines contenues dans les végétaux ne sont pas totalement équilibrées en acides aminés essentiels (déficit en méthionine, lysine, histidine, thréonine et arginine principalement) et elles comportent également de nombreux facteurs antinutritionnels (inhibiteurs de protéase, lécithines, saponines, oligosaccharides, phytates, glucosinolates, fibres, etc). Ceci nuit à leur utilisation et limite le taux de leur incorporation (Kaushik 1990; Francis et al., 2001; Opstvedt et al., 2003; Mundheim et al., 2004; Torstensen et al., 2005,2008; Aksnes et al., 2006; Espe et al., 2006, 2007; Gatlin et al., 2007; Hevrøy et al., 2008; Miller et al., 2008; Turchini et al., 2009, 2011; Crampton et al., 2010; Pratoomyot et al., 2010 FROM Eldar Åsgard Bendiksen et al., 2010 ).
L’incorporation d’ingrédients d’origine végétale dans les aliments pour poissons a induit de nombreuses perturbations physiologiques chez les poissons. Les farines et huiles végétales dans les aliments engendrent un refus alimentaire qu’il est possible de palier par l’ajout d’attractants (Tulli 2007). La supplémentation en acides aminés essentiels de synthèse, comme attractant, a en effet permis d’améliorer la prise alimentaire. Cet ajout en acides aminés se rapprochant du besoin nutritionnel des truites, il en résulte une plus forte croissance des poissons nourris avec des aliments à forte teneur en végétaux. Cependant, les acides aminés rajoutés sous forme libre ont une absorption intestinale beaucoup plus rapide que celle des autres acides aminés présents dans les protéines. Ce décalage d’absorption intestinale des différents acides aminés crée alors un déséquilibre temporel dans le profil plasmatique en acides aminés. Ce déséquilibre peut perturber la croissance des poissons, étant donné le rôle signalétique joué par les acides aminés sur l’autophagie et sur la sensibilité à l’insuline (Rolland et al. 2016).
Facteurs antinutritionnels
Les végétaux contiennent de nombreux facteurs antinutritionnels de façon constitutive ou alors suite à leur transformation . Leur teneur peut être réduite lors de la préparation de l’aliment, particulièrement lors de la montée en température pendant l’extrusion, ou alors par dépelliculage des graines pour réduire la présence de fibres, ou par extraction alcoolique pour dissoudre et écarter les facteurs antinutritionnels solubles dans l’alcool. De plus lors de la cuisson des végétaux en présence d’eau, une réaction de Maillard peut se produire entre les sucres et les protéines ce qui conduit à la formation de cétosamines et diminue l’absorption intestinale des acides aminés (Machiels and Istasse 2002).
Inhibiteurs trypsiques :De nombreuses céréales et légumineuses contiennent des inhibiteurs de protéases comme la trypsine, la chymotrypsine, la carboxypeptidase, l’élastase ou de l’α-amylase. Le soja est la céréale la plus riche en inhibiteur de Kunitz, qui est un inhibiteur trypsique. Mais il est possible de réduire considérablement cet inhibiteur par la cuisson-extrusion de la céréale. En cas d’alimentation avec du soja non transformé, les facteurs antitrypsiques présents en grande quantité peuvent provoquer une hypertrophie du pancréas comme cela a été rapporté chez la carpe (Catla Catla) (Patnaik et al. 2005). Cette hypertrophie a été attribuée à une réponse physiologique de l’organisme face à une absorption protéique intestinale diminuée.
Tanins :Les tanins ont la propriété de précipiter sous forme de complexes protéiques les protéines solubilisées de l’aliment, réduisant sa digestibilité protéique. Leur teneur peut être diminuée par dépelliculage, traitement alcalin (Francis et al. 2001), ou lors de l’extrusion (Mukhopadhyay et al. 2007).
Acide phytique :Les phytates chélatent certains minéraux (phosphore, calcium, cuivre, zinc, fer) ainsi que les protéines, ce qui diminue leur biodisponibilité. L’ajout de phytase, permettant de remédier à ce problème, est très utilisé en aquaculture (Gilani et al. 2012).
Glucosinolates :Les glucosinolates sont des thioglucosides communément retrouvés chez les crucifères comme le colza. Leurs présences dans l’aliment entraînent un hypofonctionnement de la thyroïde chez les poissons (Burel et al. 2001). La sélection génétique menée sur les plantes a permis d’obtenir des variétés de colza avec de faible teneur en glucosinolate (Francis et al. 2001).
|
Table des matières
Introduction
1 SYNTHESE BIBLIOGRAPHIQUE
1.1 Aquaculture
1.1.1 Production aquacole
1.1.2 Réglementation sur l’usage de protéines d’origine animale
1.1.3 Réglementation sur l’utilisation d’antibiotiques
1.2 Physiologie de la truite autour de la nutrition
1.2.1 Ontogénie du système digestif
1.2.2 Recommandations nutritionnelles
1.2.3 Principales étapes de la digestion de la truite
1.2.4 Mesure de la digestibilité
1.3 Défis nutritionnels en aquaculture
1.3.1 Facteurs limitant l’incorporation des ingrédients végétaux dans les aliments pour
poisson
1.3.2 Réponse des truites aux aliments végétaux
1.4 Stratégie d’adaptation des truites à l’alimentation végétale en mettant à profit leur variabilité génétique
1.4.1 Utilisation de lignées sélectionnées en élevge
1.4.2 Lignées isogéniques: un outil pour l’amélioration génétique
1.5 Le microbiote intestinal
1.5.1 Composition taxonomique du microbiote intestinal chez les poissons
1.5.2 Compartimentation du microbiote au sein du tube digestif de la truite
1.5.3 Stade de développement et évolution du microbiote
1.5.4 Fonctionnalité du microbiote intestinal
1.5.5 Variables capables de favoriser certaines espèces microbiennes
2 OBJECTIFS
3 MATERIEL ET METHODES
3.1 Matériel Biologique : la truite arc-en-ciel
3.2 Etudes préliminaires réalisées sur les truites conventionnelles
3.2.1 Protocole experimental de suivi de cinétique de la transcription de gènes et de
niveaux plasmatiques sur une periode de 12h
3.2.2 Protocole experimental du suivi de cinétique de la transcription de gènes sur une période de 48h
3.3 Génétique et réponse au changement d’alimentation
3.3.1 Les lignées
3.3.2 L’alimentation
3.3.3 Etude de la transcription de gènes impliqués dans la digestion et l’absorption de
nutriments
3.3.4 Etude du microbiote associé à la muqueuse digestive de l’intestin
3.3.5 Test « challenge hypoxique » : Effet de l’aliment et du génotype sur la physiologie
de l’hôte
4 ARTICLE 1 : Postprandial kinetics of gene expression of proteins involved in the digestive
process in rainbow trout (O. mykiss) and impact of diet composition
5 ARTICLE 2 : Long Period Response (48 Hours) of Genes Coding for Proteins Involved in the Digestive Process of Rainbow Trout (Oncorhynchus Mykiss) Fed a Single Meal
6 ARTICLE 3 : Acute hypoxic challenge as an efficient test to reveal diverse adaptation
strategies to fish meal and oil diet substitution by plant feedstuff in rainbow trout isogenic lines
7 ARTICLE 4: Disentangling the effect of full plant-based diet and host genotype on the diversity of mucosa microbiota using isogenic lines in the carnivorous rainbow trout
8 ARTICLE 5: Impact of plant-based diet on the growth, feed utilization and digestive
capacities of different isogenic lines of rainbow trout
9 DISCUSSION et PERSPECTIVES
9.1 Quels acteurs de la digestion et de l’absorption intestinale sont les plus impactés par le changement de régime alimentaire ?
9.1.1 Au stade alevin
9.1.2 Au stade juvénile
9.2 Quels sont les indicateurs d’écologie bactérienne potentiellement impliqués dans la bonne ou mauvaise aptitude des truites à répondre au changement de régime alimentaire
9.2.1 Apport des lignées isogéniques pour déterminer l’impact de l’alimentation et du génotype sur les principaux indices de diversité
9.2.2 L’indice d’Eveness témoigne- t-il de l’aptitude des truites à tolérer une
alimentation végétale ?
9.2.3 L’abondance de certains taxons particuliers peut-elle être évocatrice de leur implication dans l’aptitude des truites à bien répondre à une alimentation végétale ?
9.2.4 La mesure de β-diversité peut-elle permettre d’identifier des individus plus aptes à tolérer une alimentation végétale ?
9.3 Quels caractères phénotypiques de la truite peuvent expliquer les dissimilarités observées entre les différentes communautés bactériennes
9.3.1 Le profil du mucus intestinal peut- il expliquer le profil des communautés bactériennes intestinales rencontrées sur la muqueuse de l’intestin des poissons ?
9.3.2 Des acteurs de l’immunité peuvent-il expliquer le profil des communautés bactériennes intestinales rencontrées sur la muqueuse de l’intestin des poissons ?
9.4 Quels impacts fonctionnels peut avoir le changement de communauté bactérienne, provoqué par le changement d’alimentation, pour son hôte
9.4.1 Détermination de la contribution des acides gras libres à courte chaine (SCFA) dans la réponse des truites au changement d’alimentation
9.4.2 Certaines bactéries du microbiote intestinal sont-elles impliquées dans l’homéostasie du cholestérol ?
9.4.3 Quels sont les bactéries de la communauté bactérienne présentes dans l’intestin qui sont métaboliquement actives ?
BIBLIOGRAPHIE
![]() Télécharger le rapport complet
Télécharger le rapport complet