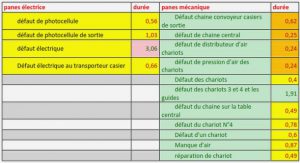
Le tissu osseux
La matrice organique est constituée à 90 % de fibres de collagène de type I et à 10 % de protéines non collagéniques, telles que l’ostéocalcine [2,3] ou des facteurs biochimiques impliqués dans la croissance osseuse [4]. Ces fibres sont organisées en une triple hélice sur lesquels des cristaux de phosphate de calcium s’apparentant à de l’hydroxyapatite (HA, Ca10(PO4)6(OH)2) viennent se déposer [1,5,6]. Cet auto-assemblage extracellulaire s’organise sur différentes échelles pour former l’os mature [5] (Figure I-1). L’os est un tissu dynamique en constante évolution, qui peut grandir ou se réparer grâce au mécanisme de remodelage osseux [8,9]. Celui-ci consiste en une élimination quotidienne de petites quantités de minéral osseux (résorption) et un dépôt égal d’un néo-tissu minéralisé (formation) [8,9]. L’équilibre entre ces deux activités détermine si l’os est formé, maintenu ou perdu. Ce processus est contrôlé par l’activité des cellules osseuses : ostéoclastes, ostéoblastes, ostéocytes. Les ostéoclastes sont les cellules osseuses spécifiques de la phase de résorption [10] et dérivent de monocytes issus de cellules souches hématopoïétiques provenant de la moelle osseuse. Ces cellules sont dotées de canaux ioniques transmembranaires capables de pomper les protons dans l’espace extracellulaire. Cette spécificité leur permet d’abaisser le pH de leur microenvironnement, entraînant une dissolution du minéral osseux par attaque acide. En parallèle, la matrice organique est détruite par attaque enzymatique [11] (➊, Figure I-2). Après formation de la lacune de résorption, les ostéoclastes meurent par apoptose en libérant des signaux biochimiques qui permettent le recrutement de macrophages et de cellules pré-ostéoblastiques issues de cellules souches mésenchymateuses (appelées aussi cellules stromales) sur le site (phase d’inversion : ➋, Figure I-2). Les macrophages préparent au comblement de la lacune et envoient des signaux biochimiques pour induire la différenciation des cellules pré-ostéoblastiques en ostéoblastes. Ces derniers, par un mécanisme encore mal caractérisé, apposent la matrice collagénique (❸, Figure I-2), appelée tissu ostéoïde, qui constitue un échafaudage pour la minéralisation. La minéralisation du tissu ostéoïde s’opère ensuite par précipitation de cristaux d’apatite entre les fibres de collagène (❹, Figure I-2) [9,12]. Cette phase de formation complétée, les ostéoblastes peuvent soit (i) mourir par apoptose, (ii) devenir des cellules bordantes à la surface de l’ostéoïde ou encore (iii) se laisser emmurer dans la matrice osseuse et devenir des ostéocytes. Les ostéocytes possèdent des prolongements cytoplasmiques qui cheminent à travers un réseau de canalicules, creusé dans la matrice osseuse et baigné de liquide extracellulaire. Ce réseau permet de relier les ostéocytes entre eux, mais également de les relier aux cellules à la surface de l’ostéoïde. Les ostéocytes assurent ainsi la communication entre le cœur de la matrice osseuse et la surface en émettant une multitude de molécules de signalisation et coordonnent l’activité de chaque cellule pour assurer un renouvellement constant du tissu osseux [13]. Particulièrement sensibles aux variations de contraintes mécaniques, ces ostéocytes s’assurent que ce tissu osseux soit adapté au mode de vie et à l’activité physique de l’individu : plus les stimuli mécaniques extérieurs sont importants et plus l’activité ostéoblastique et ostéoclastique s’appliquera à produire un os résistant [14,15].
Les petits défauts : intérêt et limites des solutions thérapeutiques actuelles
La régénération des défauts osseux de petite taille est relativement aisée, et peut être guidée et accélérée par un matériau de comblement. Celui-ci sert de support privilégié à la formation osseuse et permet d’assurer le transfert de charges nécessaire pour rétablir la fonction mécanique. Plus de 2 millions de greffes osseuses sont pratiquées dans le monde par an [37] et ce chiffre ne cesse de croître, notamment à cause des modes de vie actuels (e.g., démocratisation des sports à hauts risques, sédentarité, obésité) et de l’allongement de l’espérance de vie. Les substituts osseux utilisés actuellement sont des tissus naturels, d’origine humaine ou animale, ou encore des matériaux synthétiques [7,38]. Parmi les tissus naturels, trois catégories se distinguent :
– Les autogreffes, qui consistent en un prélèvement osseux du patient sur un autre site anatomique que le défaut osseux à combler. Ce type de greffe est considéré comme matériau de comblement idéal (« gold standard ») car contient tout le cocktail de protéines et de facteurs de croissance du patient nécessaire au recrutement des cellules non différenciées et à leur différenciation en cellules osseuses matures capable d’enclencher l’ostéoclastogénèse (on parle alors de propriétés ostéoinductives). Mais cette solution s’accompagne de nombreuses complications (e.g., douleurs sur le site anatomique de prélèvement, augmentation du risque d’infection et de morbidité, problème de disponibilité, procédures compliquées et agressives [39–41]).
– Les allogreffes, qui correspondent à un tissu osseux prélevé chez un autre individu de la même espèce [42]. Considérée comme la meilleure alternative à l’autogreffe, l’allogreffe est cependant confrontée aux mêmes problématiques (e.g., morbidité) ; à cela s’ajoute des problèmes de rejet immunitaire, particulièrement douloureux pour le receveur [43], et un défaut de propriétés ostéoinductives.
– Les xénogreffes, pour lesquelles le tissu osseux est prélevé chez un individu d’une autre espèce (e.g. tissu d’origine bovine, corail), sont moins efficaces et souvent moins bien acceptées que les deux solutions précédentes et de nombreux cas de rejet, d’infection et de contamination sont rencontrés (e.g., encéphalopathie spongiforme bovine) [44]. Une problématique commune à ces différentes solutions réside également dans la grande inhomogénéité en termes de chimie et de microstructure du greffon, qui peut conduire à une formation osseuse mal contrôlée. Des matériaux synthétiques, de forme et de chimie standardisées, potentiellement à façon, ont été développés pour pallier ces différentes problématiques. Cette catégorie regroupe aussi bien des métaux, des polymères résorbables, des bioverres, ou encore des phosphates de calcium (CaP). Les matériaux utilisés en chirurgie réparatrice sont majoritairement des CaP : l’HA, le phosphate tricalcique β (β-TCP, Ca3(PO4)2) et un mélange de ces 2 phases appelé phosphate de calcium biphasique (BCP pour Biphasic Calcium Phosphate) [45]. Leur forte similarité avec la phase minérale du tissu osseux (e.g., rigidité, composition) leur permet, d’une part, de former rapidement une interface fonctionnelle avec le tissu naturel environnant [46] et, d’autre part, de ne pas induire de réponse immunitaire (biocompatibilité) [47]. Ces matériaux présentent également une bonne capacité à supporter le développement osseux en permettant la migration et l’adhésion cellulaire au cœur de leur architecture (propriétés ostéoconductives). Par ailleurs, ils tendent à disparaître progressivement par résorption ostéoclastique et/ou par dissolution chimique et leurs produits de dégradation sont naturellement métabolisés par les cellules. Leurs propriétés de biodégradation sont également variables selon la chimie. L’HA est très peu résorbable [48] et sa vitesse de dissolution est très faible (60 mg/m²/jour in vivo) par rapport à celle de l’os naturel (400 mg/m²/jour) [49]. Au contraire, il est généralement admis que le β-TCP est à peine plus résorbable que l’HA [50] et se dissout très vite (520 mg/m²/jour in vivo) [49]. Toutefois, la vitesse de dégradation du β-TCP reste discutée encore aujourd’hui, comme le rappelle la revue de M. Bohner et al. parue en 2020 [51]. Suite à ces observations, le BCP a été développé dans l’objectif de proposer un matériau avec une solubilité intermédiaire entre celle du β TCP et celle de l’HA, et modulable, qui puisse être patient-spécifique [52,53]. Dans les faits, aucune de ces solutions ne présente de propriétés de biodégradabilité adaptées à la repousse osseuse. La lente dégradation de l’HA entraîne des problèmes de rupture à long terme par fatigue de l’implant. Au contraire, la dégradation rapide du β-TCP engendre une diminution de la résorption ostéoclastique [54,55] et le déclenchement d’une inflammation locale potentiellement délétère [56,57]. Quant au BCP, il présente en réalité une solubilité différentielle et inhomogène [58], les phases HA et β-TCP conservant le produit de solubilité qui leur est propre. Ainsi, après implantation d’un implant en BCP, la phase β-TCP se dégrade rapidement, avec, pour première conséquence, une libération de particules d’HA dans le milieu biologique [59] pouvant engendrer une réaction inflammatoire [57,60]. Seule la phase HA subsiste au niveau du défaut osseux, ce qui ralentit la vitesse d’apposition de l’os naturel [61,62]. A terme, le tissu osseux n’est pas intégralement remplacé : le défaut osseux est progressivement remplacé par un composite tissu naturel-HA dont la stabilité mécanique est remise en cause dans les travaux de Weiss et al. [63]. Outre des propriétés de biodégradation peu satisfaisantes, les CaP présentent également l’inconvénient de présenter de faibles propriétés mécaniques. Bien qu’il soit possible de les ajuster en travaillant sur la microstructure des pièces (e.g., taille des grains, porosité [64]), elles restent largement inférieures à celles de l’os naturel [45], ce qui restreint l’emploi de ces substituts osseux au comblement de défauts osseux de quelques centimètres. L’échec des implants actuels pour le comblement de défauts osseux de plus grande dimension peut également être attribué à la capacité limitée des CaP à accompagner le développement d’un nouveau tissu au cœur de l’implant. Si, dans le cas de défauts osseux de dimensions inférieures à 3 cm, leurs propriétés ostéoconductives suffisent à la régénération totale de l’os [65], celles-ci deviennent insuffisantes pour des défauts osseux de plus grande dimension. Un tissu fibreux d’encapsulation se forme à l’intérieur de l’implant et empêche la fabrication d’un tissu minéralisé [66,67]. Les CaP présentent également un défaut de propriétés ostéoinductives [46], ce qui ne leur permet pas de stimuler correctement la formation osseuse, et un défaut de propriétés angiogéniques, i.e., une incapacité à promouvoir une revascularisation suffisante du site endommagé [67,68]. Dans le cas des grands défauts osseux, la revascularisation est ralentie au point d’empêcher l’arrivée des cellules ostéocompétentes et d’entraîner une ischémie locale au cœur de la pièce. L’apport en dioxygène et en nutriment est alors insuffisant pour assurer la viabilité des cellules ostéoformatrices éloignées de plus de 200 µm des vaisseaux sanguins [69–71].
Frittage de l’HA sous atmosphère riche en CO2
Le frittage de l’HA sous atmosphère riche en CO2 est beaucoup moins documenté. A notre connaissance, seules deux études référencées dans la littérature s’y intéressent [169,187] et sont discutées dans la revue de E. Champion [228]. J. Barralet et al. montrent qu’un frittage sous atmosphère riche en CO2 décale à plus haute température le début du retrait de l’HA, et que la vitesse de retrait est augmentée par rapport à un frittage sous air [169]. La température de fin du retrait serait plus faible sous atmosphère riche en CO2 que sous air (50 °C d’écart), et le retrait final serait moins important. Il montre également qu’un frittage sous atmosphère riche en CO2 conduit à un grossissement granulaire plus important que sous air et peut conduire à l’apparition d’une porosité intragranulaire ou à un gonflement des pièces suite à la libération brutale de CO2 dans la porosité fermée par décarbonatation des sites A. Etrangement, la présence de vapeur d’eau dans une atmosphère riche en CO2 n’impacterait pas le grossissement des grains. Les travaux de J-P. Lafon et al. mettent également en évidence un décalage à plus haute température du début de la densification sous atmosphère riche en CO2 [187]. Il attribue ce phénomène à l’enrichissement de la phase apatitique en ions carbonate en sites A, néfaste pour la densification. Ce constat peut paraitre surprenant étant donné que la carbonatation des site A s’accompagne d’une création de lacunes pouvant contrebalancer l’effet potentiellement néfaste des ions carbonate sur le frittage. Par ailleurs, l’étude en question compare le comportement en frittage de l’HA et d’une CaOxHA de surfaces spécifiques initiales très différentes (31,6 m²/g et 10,0 m²/g respectivement). La perte de frittabilité qu’il observe peut donc également être attribuée à ces différences morphologiques. J-P. Lafon montre également que la vitesse maximale de retrait est plus importante sous atmosphère riche en CO2 que sous Ar, et qu’elle l’est d’autant plus si la poudre possède des ions carbonate en sites A au début de l’analyse dilatométrique (il s’agit alors d’une CaOxHA) [187]. La présence d’ions carbonate en sites A avant le frittage favoriserait ainsi la densification et conduirait à un retrait final plus important (1,2% de retrait linéaire supplémentaire) [148]. Contrairement à J. Barralet et al., J-P. Lafon observe un retrait équivalent sous atmosphère riche en CO2 et sous Ar en fin de frittage de l’HA et une fin de retrait décalée à plus haute température sous atmosphère riche en CO2 par rapport à sous Ar. Les résultats de la littérature concernant l’influence d’une atmosphère riche en CO2 sur le comportement en frittage de l’HA sont donc non seulement peu nombreux, mais aussi discordants.
|
Table des matières
Introduction générale
Synthèse bibliographique
I.1 Le comblement osseux
I.1.1 Physiologie de l’os
I.1.1.1 Le tissu osseux
I.1.1.2 La régénération osseuse
I.1.2 Les traitements thérapeutiques des défauts osseux
I.1.2.1 Les petits défauts : intérêt et limites des solutions thérapeutiques actuelles
I.1.2.2 Stratégie pour le soin des grands défauts osseux
I.2 Les apatites phosphocalciques
I.2.1 Structure
I.2.1.1 L’hydroxyapatite phosphocalcique stœchiométrique
I.2.1.2 Les hydroxyapatites carbonatées
I.2.2 Stabilité thermique
I.2.2.1 Stabilité thermique de l’HA
I.2.2.2 Stabilité thermique des CbHA
I.2.3 Caractérisation de la composition chimique des sites A
I.2.3.1 Contrôle de la composition chimique des sites A d’une apatite non carbonatée
I.2.3.2 Contrôle de la composition chimique des sites A d’une apatite carbonatée
I.3 Stratégie de l’étude
Réactivité
II.1 Article
II.1.1 Positionnement de l’étude
II.1.2 Manuscrit
II.2 Complément 1 : Caractérisation de l’atmosphère
II.2.1 Mise en évidence de la présence de vapeur d’eau
II.2.2 Identification de l’origine de la vapeur d’eau
II.2.3 Quantification de la pression partielle en vapeur d’eau
II.2.4 Résumé
II.3 Complément 2 : Cinétique réactionnelle
II.3.1 Préliminaires
II.3.2 Résultats expérimentaux
II.3.3 Discussion
II.4 Conclusion
Stabilité thermique
III.1 Stabilité thermique de l’HA
III.1.1 Préliminaires
III.1.1.1 Etat de l’art
III.1.1.2 Résultats expérimentaux
III.1.2 Modélisation de la stabilité thermique de l’HA
III.1.2.1 Problématique, objectifs et stratégie
III.1.2.2 Modèle
III.1.3 Résumé
III.2 Stabilité thermique des CbHA
III.2.2 Préliminaires
III.2.2.1 Etat de l’art
III.2.2.2 Résultats expérimentaux
III.2.3 Modélisation de la stabilité thermique des CbHA
III.2.3.1 Problématique, objectifs et stratégie
III.2.3.2 Modèle 1
III.2.3.3 Modèle 2
III.2.4 Résumé
III.3 Conclusion
Frittage
IV.1 Préliminaires
IV.1.1 Rappels bibliographiques
IV.1.1.1 Généralités sur le frittage
IV.1.1.2 Frittage réactif de l’HA
IV.1.2 Positionnement de l’étude
IV.1.3 Matériels et méthodes
IV.1.3.1 Préparation des échantillons
IV.1.3.2 Conditions de frittage
IV.1.3.3 Caractérisations physico-chimiques et microstructurales
IV.2 Influence de l’atmosphère sur le frittage de l’HA stœchiométrique
IV.2.1 Préparation et caractérisation de la poudre de départ
IV.2.1.1 Elaboration et caractérisation
IV.2.1.2 Stabilité thermique
IV.2.2 Etude du frittage en conditions non isothermes
IV.2.2.1 Réduction de surface sous atmosphères contrôlées
IV.2.2.2 Caractérisation des pastilles crues
IV.2.2.3 Densification sous atmosphères contrôlées
IV.2.2.4 Evolutions microstructurales
IV.2.3 Etude fondamentale des mécanismes de frittage
IV.2.3.1 Etude des mécanismes densifiants
IV.2.3.2 Etude cinétique de grossissement granulaire
IV.2.4 Résumé
IV.3 Influence de la composition initiale des sites A sur le frittage de l’HA
IV.3.1 Préparation et caractérisation des poudres de départ
IV.3.1.1 Détermination des compositions initiales
IV.3.1.2 Stabilité thermique
IV.3.2 Etude du frittage en conditions non isothermes
IV.3.2.1 Caractérisation des pastilles crues
IV.3.2.2 Densification sous atmosphères contrôlées
I.1.1.1 Evolutions microstructurales
IV.3.3 Etude fondamentale complémentaire des mécanismes de densification
IV.3.4 Résumé
IV.4 Conclusion
Conclusion générale
![]() Télécharger le rapport complet
Télécharger le rapport complet