Métabolisme lipidique
Matériels et méthodes
Sujets et patients
La population étudiée a été composée de 30 patients atteints de LNH agressif (16 hommes, 14 femmes ; âge : 54,3 ± 3,0 ans) et 30 sujets sains contrôles (15 hommes, 15 femmes ; âge de 49,30
± 2,1 ans), admis au Service d’Hématologie du Centre Hospitalier et Universitaire de Tlemcen. Les caractéristiques démographiques des patients et contrôles ont été enregistrés à l’aide d’un questionnaire. Un consentement éclairé a été signé par tous les participants à cette étude, conformément aux Déclarations d’Helsinki (annexes). 21% stade I, 26% stade II, 16% stade III et 26% stade IV. Les fréquences des atteintes ganglionnaires et extra-ganglionnaires ont été: adénopathie superficielle 35% des cas, ORL amygdalien 20% des cas, mésentérique 25% des cas, rate10 % des cas, médiastin 10% des cas, et moelle osseuse 10% des cas, foie 10% des cas (tableau 3.1). Tous les patients ont été soumis à la chimiothérapie de première ligne (CHOP: cyclophosphamide, adriamycine, oncovin, prednisone), avec un nombre de cures compris entre un et huit.
Questionnaire et enquête alimentaire
L’enquête alimentaire est basée sur un questionnaire alimentaire semiquantitative dans une étude rétrospective (Morin, 2007). Après le recueil des données, Le calcul des apports alimentaires et énergétiques est réalisé à l’aide d’un logiciel intégrant la composition des aliments consommés Regal plus.
Prélèvements sanguins
Les prélèvements ont été réalisés le matin (8 : 00h-10 : 00h) à jeun, au niveau de la veine du pli du coude. Le sang est collecté dans des tubes secs, identifiés préalablement.
Les tubes ont été centrifugés dans les 20 minutes après chaque prélèvement à 3000 tours/min, pendant 15 minutes et les surnageants ont été transférés dans des tubes Eppendorf, puis congelés à –20°C (congélateur du Laboratoire d’Immunologie).
Description des méthodes utilisées
Isolation de la fraction HDL des LDL et VLDL à partir de sérum (annexe)
La séparation de la fraction HDL des autres lipoprotéines a été réalisée par la méthode de référence MONICA Manual-standardization of Lipid measurement/WHO, 1998).
Principe :
A pH neutre, les polyanions, en présence de cations divalents, peuvent former des complexes insolubles avec les lipoprotéines (lipopolyanions-cations). La précipitation des lipoprotéines se fait grâce aux polyanions qui se combinent aux lipides des lipoprotéines et non aux apolipoprotéines.
Généralement, les polyanions utilisés sont les sulfates (SO3-), polysaccharides (héparine) et l’acide phosphotungstique, alors que les cations sont Ca++, Mn++ et Mg++.
L’acide phosphotungstique est un hétéropolyacide inorganique qui possède comme les polysaccharides sulfatés, des groupes polaires à forte charge électronégative et exerce une activité de type héparinique.
Il a été constaté que la précipitation complète des LDL et VLDL ne sera atteinte que si le pH du mélange sérum et le réactif de précipitation (phosphotungstate-Mg2+) soit environ 7,6.
Dosage des lipides et lipoprotéines
Dosage du cholestérol : Kit SPINREACT, S.A.U., Ctra. Santa Coloma, 7 E-17176, Sant Esteve De Bas, GI, Spain) : CHOD-POD
Il s’agit d’une méthode enzymatique. Les esters du cholestérol sont hydrolysés par le cholestérol ester hydrolase en cholestérol libre et acide gras. Le cholestérol libre produit et celui préexistant est oxydé par un cholestérol oxydase en A4 Cholestérol et peroxyde d’hydrogène. Ce dernier, en présence de peroxydase, oxyde le chromogène en un composé coloré en rouge.
La lecture des densités optiques se fait par colorimètre 252 M&O à 520 nm contre le blanc réactif. La coloration est stable pendant une heure (Natio et al., 1984 ; Meiattini et al.,1978).
Dosage des triglycérides : Kit SPINREACT, S.A.U., Ctra. Santa Coloma, 7 E-17176,
Sant Esteve De Bas, GI, Spain : GPO-PODLe dosage des triglycérides se fait par voie enzymatique. Par l’action de lipases spécialisées, lipoprotéines lipase (LPL), les triglycérides sont hydrolysés en glycérol et en acide gras libre. Le glycérol est ensuite transformé en glycérol-3-phosphate (G3P) et adénosine diphosphate (ADP) par glycérol kinase et ATP. Le G3P est ensuite converti par glycérol phosphate déshydrogénase (GPO) en Dihydroxy-acétone (DAP) et peroxyde d’hydrogène (H2O2). Ce dernier réagit avec 4-aminophenazone (4-AP) et p-chlorophenol en présence de peroxydase (POD) donne un composé coloré en rouge.
La concentration en quinone colorée (rose) mesurée à 505 nm (500-550) est directement proportionnelle à la quantité de TG contenue dans l’échantillon (Buccol et al., 1973 ; Fossati et al., 1982 ; Kaplan et al., 1984).
Electrophorèse des lipoprotéines α, β et pré-β
L’électrophorèse des lipoprotéines est une méthode d’analyse (identification et dosage) et de fractionnement, basée par la migration différentielle de particules, chargées électriquement, sous l’influence d’un courant électrique en milieu tamponné tris-barbital buffer à pH 8,8 et sur un support déterminé « acétate de cellulose ».
Détermination de quelques paramètres du stress oxydatif
Détermination du pouvoir antioxydant total du plasma (ORAC)
Le pouvoir antioxydant total du plasma, c’est à dire sa capacité à absorber les radicaux oxygènes libres (ORAC). Estimé par la capacité des hématies à résister à l’hémolyse induite par les radicaux libres in vitro en présence du plasma selon la méthode de Blache et Prost (1992).
Cette méthode est basée sur le suivi en fonction du temps de l’hémolyse des globules rouges induite par un générateur de radicaux libres. Il s’agit de soumettre une suspension d’hématies à une agression radicalaire dans des conditions strictement contrôlées, et standardisées, tous les systèmes enzymatiques et chimiques de l’échantillon se mobilisent pour protéger l’intégrité des cellules jusqu’à leur lyse.
L’addition d’une quantité déterminée d’un antioxydant vitamine E (Trolox) ou vit C (Acide ascorbique) permet de neutraliser une quantité de radicaux libre dans le milieu d’incubation ce qui induit la protection des globules rouges contre l’attaque des radicaux libres et l’hémolyse. La courbe de cinétique de lyse des globules rouges est donc déviée et un décalage de la courbe est observé en fonction du temps.
Le plasma contient plusieurs systèmes de défenses antioxydants et permet aussi la protection des globules rouges contre l’attaque radicalaire. En présence du plasma, un décalage de la courbe de la cinétique d’hémolyse des globules rouges et aussi observé.
Dosage des malonaldéhyde (MDA)
Les produits secondaires de l’oxydation des lipides les plus couramment dosés sont les aldéhydes. L’acide thiobarbiturique (TBA) réagit avec le malonaldéhyde (MDA) pour former un complexe de couleur rose et /ou jaune, possédant un maximum d’absorption à une longueur d’onde de 532 nm. De nombreuses adaptations de cette méthode ont été proposées (Vincke, 1970 ; Guillén-Sans et Guzmàn- Chozas, 1998 ; Wang et al., 2002). D’autres aldéhydes résultant de l’oxydation des AGPI à long chaine réagissent également avec l’acide 2-thiobarbiturique pour former un complexe coloré (Sun et al., 2001). La concentration en substances réactives au TBA (sr-TBA), exprimée en équivalent MDA, est évaluée par la lecture de l’absorbance au spectrophotomètre visible des sr-TBA extraites des échantillons par l’acide trichloroacétique (TCA) en milieu acide (pH 1-2) et à haute température (70°C-100°C).
Mesure des taux d’oxydation des LDL (LDL-BCD)
Principe
Les diènes conjugués (DC) sont les produits primaires de l’oxydation des lipides. Elles se forment par réarrangement des doubles liaisons du radical lipoyle des acides gras polyinsaturés. Les DC possèdent un maximum d’absorption à λ=233 nm (Klein, 1970 ; Gray, 1978 ; Corongiu et Banni, 1994).
Dosage de CRP par technique d’immunoagglutination (kit SPINREACT, S.A.U., Ctra. Santa Coloma, 7 E-17176, Sant Esteve De Bas, GI, Spain)
Le dosage de la CRP se fait à partir d’échantillon sanguin par une technique d’immunoagglutination associée à des dilutions sériées de deux en deux, en utilisant des anticorps anti-CRP fixés sur des particules de latex.
Détermination du niveau des protéines sériques
Dosage des protéines totales par la méthode de Biuret
La méthode de Biuret permet d’obtenir un dosage rapide des protéines. En milieu alcalin, les ions de cuivre (Cu++) réagissent avec les liaisons peptidiques des protéines et forment un complexe pourpre caractéristique avec coloration violette photométrique comme explique symboliquement ci-dessous.
Solution
Protéine + Cu++ Complexe Cu-protéine colore Alcalin
L’intensité de coloration du complexe Cu-protéine est proportionnelle à la concentration en protéine.Le réactif de Biuret contient de sulfate de cuivre (CuSO4) qui donne la coloration bleu au réactif, de tartrate de sodium-potassium qui empêche la précipitation des ions Cu++, de l’hydroxyde de cuivre et l’iodure de potassium qui empêche l’auto réduction de cuivre.
Electrophorèse des protéines sériques
Dés le début du vingtième siècle, les chercheurs ont pensé à se servir du champ électrique pour séparer des molécules présentes dans une solution, en fonction de leurs charges électriques et leurs volumes. Et c’est en 1937 que Tiselius a mis au point la première électrophorèse en milieu liquide, puis en 1941 la technique a évoluer vers des applications sur des supports solides : c’est l’électrophorèse de zone (Daunizeau, 2003). Parmi les techniques d’électrophorèses de zone les plus utilisés aujourd’hui, surtout pour l’étude des protéines du sérum est la technique d’électrophorèse sur acétate de cellulose.Cette technique sert à séparer les protéines sériques humaines en cinq (5) fractions bien résolues et distinctes. Ces cinq (5) fractions sont habituellement désignées par albumine, alpha-1, alpha-2, beta et gamma.Cette méthode a pour but de séparer les différentes fractions protéiques présentes dans le sérum en fonction de leurs charges électriques et leurs volumes, sous l’influence d’un courant électrique en milieu tamponne et sur un support détermine « l’acétate de cellulose ».Placée dans un milieu de pH supérieur à leur pHi (la valeur de pH du milieu ou la charge de la molécule soit nulle), les protéines sont toutes chargées négativement et se comportent comme des anions. Sous l’action d’un champ électrique, elles se déplacent vers l’anode (+).La majorité des protéines ont un pHi inferieur à 7, c’est pour cette raison qu’on utilise le plus souvent des solutions tamponnées à pH 8,6 pour permettre à toutes les protéines de se charger négativement et se déplacer vers l’anode.
Traitements statistiques
La comparaison de moyennes a été réalisée au moyen du test-t de Student. La relation entre deux variables a été effectuée par le test de corrélation de Pearson ou Spearman. Le logiciel SPSS 16.0 a été utilisé pour l’ensemble des analyses et les valeurs de p < 0,05 ont été considérées comme seuils de signification.
Résultats et interprétation
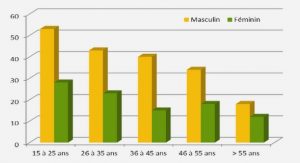
Les caractéristiques démographiques des patients et contrôles sont présentés dans le tableau 4.1. L’âge moyen, la proportion de sexes et l’indice de masse corporelle (IMC) sont comparables entre les deux groupes (p > 0,05).Une perte de poids non négligée est constatée depuis le diagnostic du LNH chez les patients atteints. En revanche, la fréquence de la consommation de tabac est plus élevée chez les malades comparés aux contrôles (p = 0,000).
|
Table des matières
1. Introduction
2. Bibliographie
2.1 Définition du lymphome non hodgkinien
2.2 Classification des LNHs.
2.2.1 Base des classifications
2.2.1.1 Histogenèse
2.2.1.2 Morphologie
2.2.1.3 Immunophénotype
2.2.1.4 Biologie moléculaire
2.2.1.5 Cytogénétique
2.2.2 Description des principales entités anatomocliniques selon la classification OMS
2.3 Epidémiologie
2.3.1 Influence de l’âge
2.3.2 Influence du sexe
2.3.3 Influence de la race
2.4 Etiologie des LNHs
2.4.1 Conditions de vie
2.4.1.1 Régime alimentaire
2.4.1.2 Données anthropomorphiques et activité physique
2.4.1.3 Tabac et alcool
2.4.2 Consommation de drogues et de médicaments
2.4.2 .1 Les drogues
2.4.2. 2 Les médicaments
2.4.3 Environnement
2.4.3.1 Les pesticides
2.4.3.2 Pollution industrielle et utilisation de produits chimiques
2.4.3.3 Activité professionnelle
2.4.3.4 Exposition aux radiations
a. Radiations ionisantes
b. Radiations ultraviolettes: UV
2.4.4 Associations Pathologiques
2.4.4.1 Les maladies à médiation immune
2.4.4.2 Lymphomes et allergies
2.4.4.3 Immunosuppression congénitale et lymphomes
2.4.4.4 Autres maladies.
a. Cancers
b. Maladie de Hodgkin
2.5 Métabolisme lipidique
2.5.1 Lipoprotéines du plasma humain
2.5.2 Apoliprotéines du plasma humain
2. 6 Stress oxydatif
2. 6.1 Définition du Stress oxydatif
2. 6.2 Les prooxydants
2.6.2.1 Définition des radicaux libres
2.6.2.2 Mode d’action des radicaux libres
2. 6.3 Les antioxydants
2. 7 L’électrophorèse des protéines sériques
3. Matériels et méthodes
3.1 Sujets et patients
3.2 Questionnaire et enquête alimentaire
3.3 Prélèvements sanguins
3.4 Description des méthodes utilisées
3.4.1 Isolation de la fraction HDL des LDL et VLDL à partir de sérum
3.4.2 Dosage des lipides et lipoprotéines
3.4.2.1 Dosage du cholestérol : Kit SPINREACT, S.A.U., Ctra. Santa Coloma, 7 E-17176, Sant Esteve De 10 Bas, GI, Spain):CHOD-POD
3.4.2.2 Dosage des triglycérides : Kit SPINREACT, S.A.U., Ctra. Santa Coloma, 7 E-17176, Sant Esteve De 14 Bas, GI, Spain : GPO-POD
3.4.2.3 Electrophorèse des lipoprotéines α, β et pré-β
3.4.3 Dosage du paramètre du stress oxydatif
3.4.3.1 Détermination du pouvoir antioxydant total du plasma (ORAC)
3.4.3.2 Dosage des substances réactives à l’acide thiobarbiturique (sr-TBA)
3.4.3.3 Mesure des taux d’oxydation des LDL (LDL –BCD)
3.4.4. Dosage de CRP par technique d’immunoagglutination (kit SPINREACT, S.A.U., Ctra. Santa Coloma, 7 E-17176, Sant Esteve De Bas, GI, Spain)
3.4.5 Détermination du niveau des protéines sériques
3.4.5.1 Dosage des protéines totales par la méthode de Biuret
3.4.5.2 Electrophorèse des protéines sériques
3.5 Traitements statistiques
4. Résultats et interprétation
5. Corrélation entre les différents paramètres
6. Discussion
7. Conclusions et perspectives
8. Références Bibliographiques
Annexes
![]() Télécharger le rapport complet
Télécharger le rapport complet