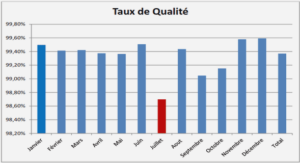
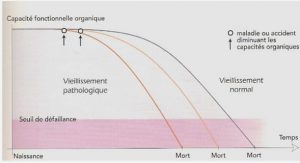
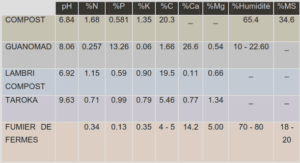
Apparues il y a quelques 3,8 milliards d’années, les bactéries ont été les premiers êtres vivants confrontés au problème de vie en dehors de la soupe primordiale. La solution fût d’enfermer un peu de cette soupe primordiale à l’intérieur d’une cellule. La cellule ainsi formée conduisit à la notion du soi – ce qui est l’intérieur – et du non soi – ce qui est à l’extérieur. La séparation entre l’intérieur et l’extérieur est assurée par l’enveloppe. Cette barrière est bien plus qu’une simple frontière. Elle est le siège de nombreuses fonctions. L’enveloppe des bactéries est une structure complexe qui assure les échanges sélectifs et réciproques entre l’intérieur de la cellule et son environnement. Ces échanges sont de trois types : flux de matière, flux d’énergie et flux d’information. La compréhension de l’enveloppe et de ses constituants est donc primordiale dans la compréhension du rôle qu’elle joue dans les processus dynamiques nécessaires à la vie de la bactérie. La présence au sein de cette enveloppe de glucanes périplasmiques osmorégulés (OPG) ou oligosaccharides dérivés des membranes (MDO) a été mise en évidence en 1942 par McIntire et collaborateurs [1]. Les recherches menées dans l’équipe de Génétique des Enveloppes Bactériennes portent sur la compréhension du mécanisme de biosynthèse de ces glucanes, de leurs fonctions au sein de l’enveloppe et de la bactérie. Cette étude s’inscrit naturellement dans cette thématique et porte sur l’établissement d’un modèle de compréhension du rôle biologique des OPG chez la bactérie phytopathogène Dickeya dadantii.
La structure de l’enveloppe des Protéobactéries
Chez les bactéries à Gram négatif, l’enveloppe se compose de deux membranes, une membrane cytoplasmique ou cellulaire et une membrane externe, séparées par un compartiment aqueux : le périplasme (Fig. 1).
La membrane cytoplasmique
La membrane cytoplasmique ou cellulaire est une membrane classique composée d’une bicouche lipidique. Elle contient des protéines et des lipides en proportions égales. Cette bicouche lipidique se compose de trois espèces majeures de phospholipides : les phosphatydiléthanolamines, les phosphatidylglycérols et des cardiolipides [2]. Ces derniers sont constitués de glycérol-3-phosphate estérifié par deux acides gras, acide palmitique, acide palmitoléique, acide myristique, acide cis-vaccénique, en position 1 et 2. La structure de ces acides gras (longueur, saturation) varie en fonction des conditions physico-chimiques de l’environnement [3]. Enfin, les proportions en phospholipide impactent de nombreux processus cellulaires notamment la réplication du chromosome et la translocation des protéines.
Les protéines, plus d’une centaine d’espèces différentes, sont en proportions variables selon les conditions environnementales afin de permettre une adaptation adéquate à ces changements [5]. Ces protéines participent à divers processus de synthèse notamment celle du lipopolysaccharide (LPS), du peptidoglycane, des phospholipides, des exopolysaccharides (EPS) et des glucanes périplasmiques osmorégulés (OPG). Les protéines de la membrane cellulaire sont également impliquées dans les processus de respiration, de transport ou de sécrétion de protéines, mais aussi dans la perception des variations environnementales en particulier via les systèmes à deux composants.
La membrane externe et la surface de l’enveloppe
La membrane externe
La membrane externe, spécifique des bactéries à Gram négatif, est une seconde barrière qui va protéger la cellule des variations physico-chimiques. Elle se compose d’une bicouche lipidique asymétrique. Le feuillet interne est constitué de phospholipides similaires à ceux de la membrane cellulaire. Le feuillet externe est constitué principalement de lipopolysaccharides (LPS) ; il est composé de trois parties : le lipide A, constitué de deux N-acétylglucosamines sur lesquelles sont branchés quatre à six acides gras ancrant cette partie à la membrane. Ce lipide A est surmonté du noyau constitué de divers sucres lui-même surmonté de l’antigène O, répétition multiple d’un motif de sucres en nombre limité (souvent quatre). Cette composition rend la membrane externe plus rigide et peu perméable aux molécules hydrophiles comme aux molécules hydrophobes.
Au sein de cette membrane externe, des protéines et des lipoprotéines assurant de nombreuses fonctions sont présentes. Les porines, protéines majoritaires organisées en homotrimères, forment des pores plus ou moins spécifiques et permettent le passage des molécules hydrophiles inférieure à 600 Da comme les porines OmpF ou OmpC. OmpA, organisée comme une porine, participe à la structure au même titre que la lipoprotéine de Braun. En plus de ces porines et lipoprotéines, d’autres protéines sont présentes et jouent le rôle de récepteur spécifique ou sont impliquées dans les systèmes de sécrétion (protéines, exopolysaccharides) ou de locomotion : les flagelles.
Flagelles et pili
Les flagelles et les pili sont les deux seules structures protéiques se déployant au delà de la surface bactérienne. Le flagelle est l’organe de locomotion des bactéries. Il se compose de trois parties (Fig. 2) : le moteur ou corps basal, le crochet et un filament long de 5 à 10 μm. Le flagelle permet à la bactérie de se mouvoir vers des environnements plus favorables ou moins défavorables à sa croissance.
Les pili ou fimbriae, constitués de protéines structurales nommées pilines, permettent l’attachement à différentes surfaces biotiques comme abiotiques. Plusieurs types de pili existent : les pili sexuels, impliqués dans la conjugaison bactérienne, les pili communs de type I, impliqués dans les interactions hôtepathogène pour ne citer qu’eux.
Les exopolysaccharides
Les exopolysaccharides (EPS) entourent la bactérie, ils peuvent former une capsule et jouent un rôle de protection. Ces EPS sont hydrophiles et anioniques. Ces propriétés leur permettent notamment de séquestrer les molécules toxiques cationiques, de résister à la dessiccation ou d’éviter la phagocytose. La régulation de leur synthèse dépend de conditions environnementales telles que la température ou l’osmolarité.
Le périplasme
Situé entre les deux membranes, le périplasme représente entre 8 et 40% du volume cellulaire selon les conditions environnementales en particulier l’osmolarité du milieu [7-9]. Ce compartiment aqueux [10] contient des protéines qui assurent de nombreux rôles : dans la synthèse et l’assemblage des constituants de l’enveloppe, dans la sécrétion, dans la nutrition, dans la signalisation, etc. Deux glycanes sont également retrouvés : le peptidoglycane, est un polymère unique entourant la membrane cellulaire. Il est composé d’une répétition de N-acétylglucosamine relié à un acide N-acétylmuramique sur lequel sont branchés quatre acides aminés. De nombreuses transpeptidations et transglycosylations permettent une forte réticulation de cette macromolécule conférant rigidité, forme et résistance à la pression osmotique à la bactérie. Enfin, les glucanes périplasmiques osmorégulés sont des oligosaccharides dont l’abondance varie en fonction de l’osmolarité du milieu et qui sont impliqués dans la perception des variations environnementales.
Les glucanes périplasmiques osmorégulés
Mis en évidence pour la première fois en 1942, dans une culture d’Agrobacterium tumefaciens sous la forme de glucanes cycliques β-1,2 [1] et classés initialement comme une sous classe d’exopolysaccharides, les glucanes périplasmiques osmorégulés furent mis en évidence à nouveau dans le laboratoire d’Eugene Kennedy en 1973 chez Escherichia coli. Van Golde et collaborateurs ont détecté, lors d’une étude du renouvellement des phospholipides de la membrane cellulaire chez E. coli par marquage au 32P, que le phosphoglycérol libéré lors du renouvellement du phosphatidylglycérol était transféré sur des oligosaccharides solubles du périplasme [11]. En raison de leur mise en évidence chez E. coli, ils furent nommés MDO (membrane-derived oligosaccharides). En 1986, Miller montra que ces β-glucanes étaient osmorégulés [12]. L’analyse des glucanes d’un nombre de plus en plus grand d’espèces bactériennes a montré que ceux-ci présentent plusieurs caractéristiques communes :
• le D-glucose est le seul sucre présent,
• la liaison entre ces résidus de glucoses est presque toujours une liaison βglucosidique,
• le nombre d’unités de glucose est compris entre 5 et 24.
Les MDO ne présentant pas chez toutes les espèces de substituants ne dérivant pas des phospholipides membranaires, ils furent renommés glucanes périplasmiques osmorégulés ou OPG [13]. Ces OPG sont présents chez les alpha, beta et gamma Proteobacteria [14]. Ils présentent des différences structurales et de substitution. Ces substitutions peuvent être originaires des phospholipides des membranes comme les phosphoglycérols ou les phosphoéthanolamines, ou originaires du métabolisme intermédiaire comme par exemple les résidus acétyles ou succinyles.
la structure des OPG
Les OPG sont répartis en quatre classes selon la structure glucosidique de leur squelette [13] (Fig. 3).
La famille I
La première famille comprend les OPG des entérobactéries telles que E. coli ou Dickeya dadantii et d’espèces du genre Pseudomonas comme Pseudomonas syringae. Ces oligomères sont linéaires et constitués de 5 à 12 unités de glucoses liés en β-1,2 et ramifiés en β-1,6. La branche en β-1,6 ne comporte qu’un seul glucose (Fig. 3). Chez E. coli, les OPG sont substitués par des phosphoglycérols, des phosphoéthanolamines et du succinate sur le carbone 6 [15]. Chez D. dadantii, ces OPG sont substitués par du succinate et de l’acétate. Enfin, chez P. syringae, aucun substituant n’a été trouvé.
La famille II
La seconde famille regroupe les OPG retrouvés dans la famille des Rhizobiacées notamment issus des Agrobacterium, des Rhizobium, des Sinorhizobium ou des Brucella [18]. Ces OPG sont cycliques liés en β-1,2 et comportent de 17 à 25 résidus de glucoses (Fig. 3). Ils peuvent être substitués par des résidus phosphoglycérols, succinyles ou méthylmalonyls.
La famille III
La troisième famille d’OPG a été rencontrée chez les Bradyrhizobium. Leur taille est spécifique. Ce sont des molécules cycliques de 10 à 13 résidus liés en β-1,3 et en β1,6 (Fig. 3).
La famille IV
La dernière famille regroupe les OPG de Ralstonia solanacearum, Xanthomonas campestris et Rhodobacter sphaeroides. Les OPG sont cycliques et présentent un degré de polymérisation unique : respectivement 13 [20], 16 [20, 21]et 18 [22]. Ils sont lié en β-1,2 et fermé par un glucose en β-1,6 (Fig. 3). Ils peuvent être substitués par du succinate ou du phosphoglycérol.
|
Table des matières
I)INTRODUCTION
II) GENERALITES
III) METHODOLOGIE
IV) RESULTATS
V) COMMENTAIRES ET DISCUSSION
VI) CONCLUSION
VII) REFERENCES
ANNEXES
RESUME
![]() Télécharger le rapport complet
Télécharger le rapport complet