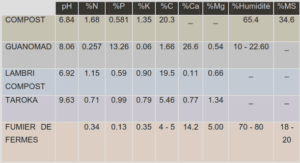
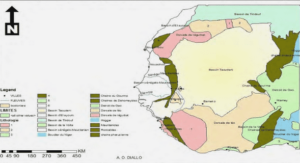
Importance des zones côtières
Les zones côtières ont longtemps joué un rôle important pour l’humanité. Du fait de leur situation à l’interface entre terre et mer, elles constituent des territoires à forts enjeux stratégiques pour les économies et pour l’environnement. Elles fournissent un large éventail de biens et services. D’un point de vue socio-économique, elles constituent des espaces privilégiés pour le développement de nombreuses activités, sources d’emplois : activités portuaires et industrielles ; agglomérations urbaines et touristiques (Allain et al., 2006, Amara, 2011). Au plan environnemental, ces écosystèmes sont parmi les plus riches et les plus productifs de la planète. On y trouve de nombreux habitats littoraux remarquables (mangroves, marais salés, lagunes, côtes rocheuses), des habitats subtidaux benthiques complexes (récifs coralliens, herbiers marins …) ainsi qu’une multitude d’environnements sédimentaires (Christian & Mazzilli, 2007). Ces derniers assurent de nombreuses fonctions biologiques et écologiques : habitats essentiels pour divers organismes (flore, ichtyofaune, avifaune), zones d’épuration et de stockage et de transformation des apports terrigènes.
Néanmoins, elles sont aussi, de par leurs propriétés, très attractives pour l’homme. Les zones côtières se trouvent ainsi soumises à de fortes pressions anthropiques qui menacent leur équilibre et leur intégrité. Depuis longtemps, les civilisations ont cherché à exploiter au mieux les zones littorales afin d’étendre leur pouvoir, leur commerce et leur culture. Depuis la seconde moitié du XXème siècle, le littoral voit sa démographie augmenter. Aujourd’hui, plus de 60% de la population mondiale habite dans les zones côtières (qui représente 12% de la surface terrestre) soit environ 4 milliards d’habitants et on prévoit que dans 25 ans, ce sera plus de 75%. Avec ce développement économique et cette croissance démographique en expansion, de fortes répercussions sont observées sur les écosystèmes notamment la destruction des habitats naturels (aménagements et activités portuaires, chenalisation, activités industrielles, pollutions, dragage, extraction de granulats, activités agricoles, marées noires, développement intensif du tourisme…) et la surexploitation des ressources (surexploitation des mers et des mangroves ainsi que le blanchissement corallien ayant des causes diverses, dont notamment le changement climatique…).
Malgré leur importance socio-économique et environnementale, les zones côtières et les milieux marins n’ont reçu une attention particulière de la part des politiques que dans des périodes récentes – l’homme étant (hors période estivale….) plutôt terrien que marin. A l’échelle européenne, les enjeux de protection de ces écosystèmes particuliers sont notamment appréhendés par la Recommandation européenne relative à la Gestion Intégrée des Zones Côtières (2002), et plus récemment par la Directive Cadre Stratégie pour le Milieu Marin (DCSMM) adoptée en 2008. Cette dernière demande en particulier aux États membres d’évaluer les enjeux et besoins de protection des zones marines qui sont de leur ressort, puis d’élaborer et mettre en œuvre d’une manière concertée des plans de gestion assurant le développement durable de ces zones. A l’échelle française, le Grenelle de la Mer a prévu la mise en œuvre d’une stratégie nationale intégrée pour la mer et le littoral (SNML) qui se déclinera en documents stratégiques de façade (DSF) pour chacune des quatre façades maritimes métropolitaines.
La zone intertidale, un environnement peu hospitalier
L’interface dynamique entre terre et mer représente l’écosystème intertidal ou l’estran. C’est la zone de balancement des marées, correspondant à l’étage médiolittoral et au supralittoral . Lorsqu’on parle de la pente d’une plage en fait c’est celle de l’estran dont il s’agit. Le profil de l’estran considéré dans son ensemble est légèrement convexe, mais avec de nombreuses irrégularités. Néanmoins, ce profil évolue constamment car il dépend des aléas climatiques tels que les marées, la force des vagues et des flux sédimentaires (importance de la dérive littorale).
La durée de l’immersion, liée à l’amplitude des marées, est le facteur majeur agissant sur la vie dans ce milieu ; elle y provoque dessiccation et déshydratation des organismes et en détermine la température et la lumière. Dans cet écosystème, les variations de température, de salinité, d’oxygène, de turbidité, etc., sont marquées et imposent diverses pressions aux organismes (Denny, 1988; Raffaelli & Hawkins, 1996). Les conditions de vie dans cet écosystème dépendent aussi de la nature du substrat, différant sensiblement selon que celui-ci soit meuble (graviers, sables, vases) ou dur (roches). De ce fait, les conditions écologiques, liées aux marées, sont plus contraignantes pour les organismes des zones à substrats durs. Les organismes peuplant les estrans rocheux sont soumis à des conditions écologiques qu’aucune protection ne peut atténuer : ils supportent avec rigueur les conséquences de l’alternance émersion-immersion, les problèmes liés à l’amplitude des variations thermiques pendant la marée basse quand la température de l’eau de mer est remarquablement stable sur de longues durées et enfin les problèmes liés aux variations de la salinité (pluie, évaporation…).
Les substrats durs étant favorables à la fixation d’organismes littoraux, les côtes rocheuses présentent un revêtement animal et végétal important les distinguant des plages sableuses. La répartition des organismes sur les estrans rocheux est dépendante de l’action de la mer: ses oscillations régulières déterminent l’étagement des peuplements et l’hydrodynamisme modifie leur composition. Sur l’estran sableux, seuls les organismes capables de s’enfouir dans le sédiment (ex. divers vers marins, bivalves …) peuvent occuper l’estran à marée basse. Ainsi, la faune et la flore de l’estran obéissent aux conditions d’émersion/immersion se répartissant selon la qualité des mécanismes leur permettant de résister à l’émersion.
La zone intertidale, une zone de nourricerie pour de nombreuses espèces marines
Au cours de leur vie et en fonction de leur stade de développement (larves, juvéniles, adultes) les poissons occupent des habitats différents : aires de reproduction, de nourricerie, de nutrition, de migration. Ce sont des milieux que l’on qualifie d’habitats essentiels puisqu’ils sont nécessaires au maintien et au renouvellement des ressources. Dans tous les cas, ces changements d’habitats ont pour but d’optimiser la croissance, la survie et le potentiel reproducteur de l’individu (Gibson, 1997). Les changements majeurs d’habitats qui ont lieu durant la vie des poissons sont communs à de nombreuses espèces. Les larves concentrées sur les frayères sont transportées passivement ou activement selon les espèces vers les zones de nourriceries où les juvéniles se développent jusqu’à maturité sexuelle (Harden Jones, 1968) .
Malgré les conditions environnementales dures et fortement variables, la zone intertidale est caractérisée par la diversité et l’hétérogénéité de sa faune ainsi que sa productivité. C’est un habitat provisoire important pour le cycle de vie ou une partie de ce cycle de beaucoup de juvénile d’organismes marins (Potter et al., 1986 ; Elliott et al., 1990 ; Amara & Paul, 2003) tels que la plie commune Pleuronectes platessa, le bar Dicentrarchus labrax, le sprat Sprattus sprattus, le gobie Pomatoschistus microps, le syngnathe Syngnatus accus ou encore la crevette grise crangon crangon pour ne citer que quelques espèces.
|
Table des matières
Chapitre 1 : Introduction générale
1.1. Importance des zones côtières
1.2. La zone intertidale, un environnement peu hospitalier
1.3. La zone intertidale, une zone de nourricerie pour de nombreuses espèces marines
1.4. Influence de l’environnement sur les communautés intertidales et leurs dynamiques
Chapitre 2 : Matériels et Méthodes
2.1. Zone d’étude
2.1.1. La manche orientale
2.1.2. La Plage sableuse de Sainte Cécile
2.2. Mesures des paramètres environnementaux et climatiques
2.2.1. Données environnementales
2.2.2. Données climatiques
2.3. Stratégie d’échantillonnage de la macrofaune
2.3.1. Engin de pêche en zone intertidale
2.3.2. Analyse des captures
2.3.2.1. Identification et analyse biométrique
2.3.2.2. Densité
2.3.2.3. Indices de diversité
2.3.2.4. La richesse spécifique
2.3.2.5. L’indice de Shannon-Weaver H’
2.3.2.6. L’indice d’équitabilité de Piélou J’
2.4. Indicateurs de performances physiologiques
2.4.1. Espèces cibles : la plie commune
2.4.2. Indice de condition morphométrique
2.4.3. Indice de croissance
2.4.4. Indice nutritionnel : rapport d’acides nucléiques ARN/ADN
2.4.5. L’indice de vacuité
2.5. Analyses statistiques
2.5.1. La méthode STATIS
2.5.2. La méthode STATICO
Chapitre 3 : Utilisation des nourriceries intertidales : influence des paramètres environnementaux
3.1. Introduction
3.2. Environmental control on fish and macrocrustacean spring community structure on an intertidal sandy beach
3.2.1. Introduction
3.2.2. Material and methods
3.2.2.1. Study area and sampling
3.2.2.2. Environmental variables
3.2.2.3. Data analysis
3.2.3. Results
3.2.3.1. Environmental parameters
3.2.3.2. Species composition
3.2.3.3. Interannual variations in community structure and species composition
3.2.3.4. Relationships between fish and macrocrustacean spring community structure and their environment
3.2.4. Discussion
3.3. Seasonal and inter-annual persistence and stability in the community structure of fish and macrocrustacean on an intertidal sandy beach: implications for biological monitoring
3.3.1. Introduction
3.2.2. Materiel and methods
3.3.2.1. Study area and sampling
3.3.2.2. Environmental variables
3.3.2.3. Data analysis
3.3.3. Results
3.3.3.1. Composition of fish and macrocrustaceans assemblages
3.3.3.2.Interannual variations of the environmental and species assemblages
3.3.3.3. Stability in the seasonal structure of the environment and species assemblages
3.3.3.4. Relationships between fish and macrocrustacean community structure and their environment
3.3.4.Discussion
Chapitre 4: Performances physiologiques des juvéniles de la plie commune Pleuronectes platessa
4.1. Introduction
4.2. Seasonal and interannual variations of biological performances of newly settled juvenile plaice Pleuronectes platessa during the spring period on an intertidal sandy beach
4.2.1. Introduction
4.2.2. Material and methods
4.2.2.1. Study area and sampling
4.2.2.2. Environmental variables
4.2.2.3. Growth and condition indices
4.2.2.3.1. RNA/DNA ratio
4.2.2.3.2. Fulton’s K condition index
4.2.2.3.3. Recent growth
4.2.2.3.4. Feeding analysis
4.2.2.4. Data analysis
4.2.3. Results
4.2.3.1. Environmental conditions
4.2.3.2. Plaice settlement and densities
4.2.3.3. Condition and growth indices
4.2.4. Discussion
Chapitre 5 : Conclusion générale
Références bibliographiques
ANNEXES