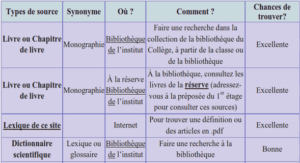
Impact des CMA sur les organismes pathogènes telluriques
1ère expérience : Colonisation de plants de tomates Heatmaster par Rhizophagus irregularis dans un système de culture in vitro MDP avec Medicago truncatula
Suite à de nombreux problèmes, aucune analyse n’a pu être réalisée :
– Le mycélium du CMA ne s’est pas développé de manière optimale dans le CH de la boite de Pétri bi-compartimentée o Seuls 8 systèmes ont été obtenus (au lieu de 20) 16 plants de tomates transplantés. Ceci a empêché de réaliser une expérience de dynamique de colonisation.
– Faible taux de survie des plants de tomates lors du transfert dans le compartiment CH du système de culture HAM-P. o Seulement 4 plants de tomates ont survécu Analyse : Après 10 jours, les 4 plants de tomates ont été arrachés
– 3 plantes ont été colorées o 1 présente une mycorhization normale (arbuscules et vésicules observables). o Les 2 autres présentent très peu d’hyphes (majoritairement extraracinaires attachés aux racines).
Au vu de ces résultats, nous n’avons pu établir de dynamique de colonisation. Cependant la colonisation racinaire a été observée après 10 jours dans les plantes qui ont survécu. La colonisation racinaire a, par ailleurs, été confirmée par d’autres expériences menées au laboratoire (communication personnelle).
2ème expérience : Détermination de la quantité d’inoculum de Ralstonia solanacearum (Rsol) à inoculer sur tomate cv. Heatmaster in vitro afin d’obtenir un flétrissement important des plants de tomates sur une période de 15 jours.
La bactérie est visible sur le milieu SRM à partir du 5ème jour après inoculation. Les boites inoculées avec 10² et 104 CFU/ml présentaient de nombreuses colonies (plus de 100) à la surface du milieu SRM. 5 de ces boites présentent un développement plus important de bactérie en surface du milieu au-dessus des racines de la plante, mais aucun signe réel de flétrissement n’est visible. Les premiers symptômes apparaissent au 7 ème jour après inoculation. Trois plantes présentaient un flétrissement bactérien avancé (plus de 4 sur l’échelle de He (1983)). C’est aussi à cette date que les colonies commencent à se développer autour des racines (10% des plantes inoculées) (Figure 22).
Après 11 jours, 6 plantes (20% des plantes inoculées) présentent de jeunes racines entourées de la bactérie R. solanacearum. En tout, 12 plantes (40% des plantes inoculées) présentent un flétrissement avancé (dont les 6 plantes développant la bactérie autour de leur racine). Après 15 jours d’observation, 53,33% des plantes inoculées étaient flétries et aucune plante témoin ne présente de symptômes avancés de flétrissement. Après la transformation (cf. Matériels et méthodes) des données recueillies le 15ème jour (uniquement), le pourcentage de flétrissement des plantes est supérieur à 60% pour le traitement à 10²CFU/ml (DI : 68 ± 9 % et PWP : 60 ± 11 %) le dernier jour de l’expérience. Le traitement 104 CFU/ml présente un pourcentage de flétrissement plus faible (DI : 58 ± 7 % et PWP : 47 ± 7 %). Pour finir, aucune plante morte n’a été observée sur les témoins eau stérile (DI : 14 ± 4 % et PWP : 0 ± 0 %).
En tenant compte de l’entièreté des données sur les 15 jours, en séparant le DI et le PWP, les traitements 10² et 104 CFU/ml sont significativement différents du témoin eau stérile selon le test de Fisher (α < 0,05) et non significativement différents entre eux. Les deux concentrations permettent de suivre correctement l’incidence de la maladie. Le modèle utilisé pour cette analyse est validé grâce à un bon graphe des résidus (meilleur dans le cas du DI) et un R² suffisant (DI : 81 % et PWP : 86 %). Dans cette analyse, une grande partie de la variance est expliquée par le bloc (43,4 % pour le PWP et 35,8 % pour le DI). Le profil des prévisions est visible à la figure 23 pour les 2 différentes échelles. L’évolution de l’index de flétrissement selon les différents blocs et les différents traitements est reprise quant à elle dans la figure 24.
En ce qui concerne l’AUDPC (qui transforme toutes les valeurs observées au cours du temps en une seule valeur), le traitement 104 CFU/ml est significativement différents du témoin eau stérile selon le test de Tukey (α < 0,05), mais non significativement différent du traitement 10² CFU/ml. Le
traitement 10² CFU/ml est significativement différent du témoin seulement avec l’échelle PWP (Tableau 2). Avec un test de Student (α < 0).
Le modèle qui nous a permis d’analyser les racines(AUDPC) est validé par un R² suffisant (PWP : 90,5 % et DI : 79 %) et un bon graphe des résidus. En utilisant le test de Tukey (α ± 0,05) sur les données racines (AUDPC), l’effet bloc (aléatoire) est non significatif pour les deux échelles. Par contre, une grande partie de la variance est expliquée par le bloc (44,4 % pour le PWP et 20,8 % pour le DI).Les graphiques des prévisions des profils pour les deux différentes échelles sont semblables (Figure25). En mesurant la parité des mesures (racine(AUDPC)) selon les deux différentes échelles, un test de Student (α ± 0,05) montre que les valeurs AUDPC de l’échelle de PWP sont significativement inférieures aux valeurs de l’échelle de He (1983).
|
Table des matières
Introduction
I. État de l’art
A. Ralstonia solanacearum
1. Symptômes et épidémiologie
2. Les différentes méthodes de lutte : avantages et limites
B. Les Mycorhizes
C. Impact des CMA sur les organismes pathogènes telluriques
1. Mécanismes de protection (Harrier and Watson, 2004)
2. Bioprotection des plants de tomates associés aux CMA face à différents agents pathogènes telluriques (excepté R. solanacearum)
3. Bioprotection des CMA contre Ralstonia solanacearum
D. Évaluation d’interactions plantes/microorganismes in vitro
1. Interactions plantes-CMA in vitro
2. Interactions plantes – micro-organismes bioprotecteurs – agents pathogènes in vitro
3. Ralstonia Solanacearum in vitro
Matériels et méthodes
I. Matériel biologique
A. Rhizophagus irregularis
B. Solanum lycopersicum
C. Ralstonia solanacearum
II. Techniques de culture in vitro
A. Préparation du système de culture in vitro HAM-P
B. Préparation du système de culture in vitro MDP
C. Maintenance des systèmes de culture in vitro HAM-P/MDP (Figure 16)
III. Dispositif expérimentaux
A. 1ère expérience : Colonisation de plants de tomates Heatmaster par Rhizophagus irregularis
dans un système de culture in vitro MDP avec Medicago truncatula
1. Etablissement de l’association in vitro
2. Evaluation de la colonisation racinaire
B. 2ème expérience : Détermination de la quantité d’inoculum de Ralstonia solanacearum (Rsol) à
inoculer sur tomate cv. Heatmaster in vitro afin d’obtenir un flétrissement important des plants de
tomates sur une période de 15 jours
1. Méthode d’inoculation de la bactérie R. solanacearum
2. Suivi du développement du flétrissement bactérien selon l’échelle de He (He, 1983) (index
de flétrissement) et selon le pourcentage de plantes flétries (PWP)(Deberdt et al., 2012)
C. 3ème expérience : Évaluation in vitro du potentiel bioprotecteur des champignons
mycorhiziens à arbuscules contre le flétrissement bactérien de la tomate
1. Suivi du développement du flétrissement bactérien grâce à l’échelle de He (1983) (Disease
index) et du nombre de plantes flétries (PWP)
2. Analyse enzymatique
IV. Analyse Stastistiques
Résultats
I. 1ère expérience : Colonisation de plants de tomates Heatmaster par Rhizophagus irregularis dans un système de culture in vitro MDP avec Medicago truncatula
II. 2ème expérience : Détermination de la quantité d’inoculum de Ralstonia solanacearum (Rsol) à inoculer sur tomate cv. Heatmaster in vitro afin d’obtenir un flétrissement important des plants de tomates sur une période de 15 jours
III. 3ème expérience : Évaluation in vitro du potentiel bioprotecteur des champignons mycorhiziens à arbuscules contre le flétrissement bactérien de la tomate
Discussion
I. Récapitulatif
II. 1ère expérience : Colonisation de plants de tomates Heatmaster par Rhizophagus irregularis dans un système de culture in vitro MDP avec Medicago truncatula
III. 2ème expérience : Détermination de la quantité d’inoculum de Ralstonia solanacearum (Rsol) à inoculer sur tomate cv. Heatmaster in vitro afin d’obtenir un flétrissement important des plants de tomates sur une période de 15 jours
IV. 3ème expérience : Évaluation in vitro du potentiel bioprotecteur des champignons mycorhiziens à arbuscules contre le flétrissement bactérien de la tomate
V. Méthode d’évaluation : Index de flétrissement (DI) et pourcentage de plantes flétries (PWP)
Annexes
I. Annexes : Milieu SRM (Modified Strullu Romand)
II. Annexe : Association entre racine et spores de CMA (Declerck et al., 2012)
III. Annexe : Préparation d’un inoculum titre (Coranson-Beaudu et al., 2010)
Références bibliographiques
![]() Télécharger le rapport complet
Télécharger le rapport complet