INTRODUCTION
Le poisson est une denrée alimentaire très appréciable pour sa valeur gustative et nutritive. Il constitue une source précieuse de protéines aisément digestibles à valeur biologique élevée. Il est aussi un excellent vecteur d’oligo-éléments et de vitamines. Ce produit aquatique est une source riche en acides gras polyinsaturés (AGPI) à longue chaine de la série n-3 et n-6 qui sont fortement recommandés en raison de leurs effets bénéfiques sur la santé humaine (Fontagné-Dicharry & Médale, 2010).L’aquaculture mondiale est un secteur dynamique en plein essor. Contrairement à la pêche qui stagne autour de 90 millions de tonnes par an, l’aquaculture connaît une croissance annuelle de près de 8,6 %, ce qui est bien supérieur à la croissance de la production animale terrestre (FAO, 2014). Pour l’année 2012, la production mondiale de poissons de consommation issus de l’aquaculture a atteint 66,6 millions de tonnes (FAO, 2014) parmi les 158 millions de tonnes produites au total entre les pêches de capture et l’aquaculture (Tableau I).L’Algérie se distingue parmi les pays méditerranéens par sa très faible production en produits de la pêche (< 3 million de tonnes). Bien que le ratio alimentaire soit passé de 3,02 en 1999 à 5,4 kg/hab/an en 2010 (FAO, 2012), cela reste bien en dessous de la moyenne mondiale, qui a été estimée en 2012 à 19,2 kg/hab/an (FAO, 2014) et qui ne cesse d’augmenter (Tableau I).La couverture du déficit en poisson en Algérie ne peut être assurée par la pêche maritime du fait de l’étroitesse de son plateau continental, l’ancienneté de sa flotte de pêche et par l’escarpement de sa côte. La vulgarisation de l’aquaculture ainsi que l’introduction sur le marché national de nouvelles espèces de poissons semblent être de très bonnes résolutions pour remédier à ce manque. Dans cette perspective, un programme quinquennal 2009-2014 a été planifié. Ce dernier se base principalement sur le lancement de sept pôles d’activités aquacoles (désignées par des lettres de A à F sur la Figure 1 et dans le Tableau II) et sur l’exploitation de différentes ressources hydriques à travers le territoire national.
Oxydation des lipides
a. La lipolyse :
La stabilité des lipides vis-à-vis de l’oxydation dépend de leur localisation dans les différents tissus (Eymard, 2003). Les lipides du muscle de poissons sont enclins à la peroxydation en raison de leur importante teneur en AGPI (Yarnpakdee et al., 2012). La lipolyse est l’un des principaux mécanismes de dégradation post mortem des lipides qui permet la libération des A.G.P.I. (Eymard, 2003). C’est un phénomène enzymatique qui se déroule dans la chair crue au cours de sa maturation ou conservation. Elle n’est pas observée dans la viande cuite car la cuisson dénature les enzymes lipolytiques. La lipolyse est catalysée par des enzymes spécifiques : les lipases et les phospholipases (Van Der Bosch, 1980) qui présentent un pH d’activité optimale basique (Alanasier, 1996). Chez les poissons, il s’agit de la phospholipase C (PLC) et de la phospholipase A2 (PLA2). Les phospholipases A1 et D étant des voies mineures (Bacot, 2004). Ces enzymes hydrolysent les liaisons esters des glycérides et libèrent à partir des triglycérides (T.G.) des acides gras libres (A.G.L.), des monoglycérides (M.G.) et des diglycérides (D.G.) (Eymard, 2003). L’activité lipolytique, bien que faible, persiste lors de la conservation à l’état congelé. Ces réactions de lipolyse induisent une dégradation du produit. De plus, les acides gras libérés interagissent avec les protéines favorisant leur dénaturation et conduisant à l’altération du poisson (Azhar & Nisa, 2006).
b. La peroxydation lipidique
Dans les conditions normales (poissons vivants), la peroxydation lipidique existe. C’est un processus physiologique naturel et continu d’ordre enzymatique, indispensable à la synthèse des prostaglandines et leucotriènes, à la leucocytose, à la phagocytose et aux remaniements des membranes cellulaires (Marcel, 2002). En condition post mortem, on parle de peroxydation lipidique non enzymatique ou spontanée. C’est un processus oxydatif d’altération des lipides portant essentiellement sur les AGPI. En effet, il est établi que les AGPI sont des cibles privilégiées en raison de leurs doubles liaisons bis-allyliques facilement oxydables (Servais,2004). De plus, les acides gras saturés (AGS) ne s’oxydent qu’à des températures supérieures à 60°C, tandis que les acides gras polyinsaturés s’oxydent même lors de l’entreposage des poissons à l’état congelé (Favier 2003). Par ailleurs, les triglycérides sont peu réactifs parce qu’ils contiennent des acides gras à courte chaîne (2 ou 3 doubles liaisons). Ils sont regroupés dans des gouttelettes, ils n’ont que peu de contact avec les catalyseurs de l’oxydation qui sont localisés dans la phase aqueuse des cellules adipeuses et musculaires. En fonction de l’agent initiateur, on classe l’oxydation des lipides en 3 types :
l’auto-oxydation catalysée par la température, les ions métalliques et les radicaux libre ;
la photo-oxydation, initiée par la lumière en présence de photo-sensibilisateurs ;
l’oxydation enzymatique initiée par la présence des enzymes d’oxydation.
Lorsque le tissu est vivant, il existe des mécanismes naturels de contrôle qui permettent de prévenir la destruction oxydative des lipides membranaires, des protéines et des acides nucléiques. Le dérèglement intervient lors de la destruction du tissu (Hultin, 1994), notamment lors de la dégradation des membranes (Huang et al., 1993).L’oxydation des lipides est conditionnée par différents facteurs, à savoir, la composition en acides gras, le nombre et la position des insaturations, la présence de pro-oxydant (ions métalliques et enzymes) ou d’antioxydants naturels (tocophérols, caroténoïdes, etc…),la surface exposée à l’oxygène, la température, la lumière, etc… L’oxydation des lipides peut résulter de causes multiples. Ainsi l’auto-oxydation est catalysée par la température, les ions métalliques et les radicaux libres. La photo-oxydation est initiée par la lumière en présence de photo-sensibilisateurs. L’oxydation enzymatique est initiée par la lipoxygénase. Il s’agit dans tous les cas d’une réaction auto-catalytique, par enchainement de réactions radicalaires se déroulant en trois étapes (Figure 5). Au cours de la première étape « amorçage ou initiation », un atome d’hydrogène est arraché à un acide gras insaturé.Très rapidement une molécule d’oxygène se fixe sur ce radical lipidique. Le radical peroxyle ainsi formé est très réactif. Il arrache un atome d’hydrogène à un autre acide gras pour former un hydroperoxyde, propageant ainsi la réaction. Les hydroperoxydes sont des molécules intermédiaires importantes qui peuvent refléter l’état oxydatif d’un aliment par de simples méthodes de dosage (Al-Sayed, 2007). Cependant, ce sont des composés instables, sans odeur particulière, qui se dissocient, en particulier en présence d’ions métalliques, par scission homolytique de la liaison O-O pour former un radical alcoyl et un radical hydroxyle (radicaux libres) qui interviennent dans une série de réactions complexes aboutissant notamment à la formation de composés secondaires. Ces derniers sont constitués de dizaines de molécules volatiles de faible poids moléculaire et de molécules non volatiles. Certaines molécules volatiles possèdent une odeur propre et peuvent être réactives (aldéhydes), et donc susceptibles de réagir avec d’autres constituants tel que les protéines. Des produits de fin de réaction, de structures et de propriétés diverses, sont ainsi formés. Il s’agit de la terminaison de la réaction.
Amines biogènes
Les amines biogènes (ABs) sont des composés azotés basiques non volatils de faible poids moléculaire. Elles peuvent être classées selon leurs structures chimiques en : amines aliphatiques (putrescine, cadavérine, spermine, spermidine), aromatiques (tyramine,phényléthylamine) ou hétérocycliques (histamine, tryptamine). Elles peuvent aussi être divisées en monoamine (tyramine), diamines (histamine, putrescine et cadavérine) ou polyamines (spermine et spermidine) en fonction du nombre de groupes amines. Les ABs peuvent se former par amination et transamination d’aldéhydes et de cétones (Zaman et al., 2009) ou principalement par décarboxylation d’acides aminés libres (Onal, 2007 ; EFSA, 2011 ; Prester,2011). Les ABs sont naturellement formées et dégradées par le métabolisme des animaux, des plantes et des micro-organismes. Cependant, leur formation n’est possible que lorsque trois conditions sont réunies : disponibilité d’acides aminés libres, présence des micro organismes avec la voie catabolique appropriée et présence d’un environnement favorable à l’activité de décarboxylation (Kantaria & Gokani, 2011).Des Enterobacteriaceae appartenant aux genres Citrobacter, Klebsiella, Escherichia, Proteus,Salmonella et Shigella sont associées à la production de quantités considérables de putrescine,de cadavérine et d’histamine dans les produits de la pêche et les viandes (Russo et al., 2010). Des Vibrionaceae, des bactéries lactiques, des espèces de pseudomonas et des clostridies peuvent aussi être impliqués (Duflot, 2009).En général, le nom de l’amine biogène correspond au nom de l’acide aminé dont il dérive; ainsi,l’histamine, la tyramine et la cadavérine sont formées à partir de l’histidine, la tyrosine et la lysine, respectivement. La putrescine est constituée selon deux voies différentes : par la décarboxylation de l’ornithine ou l’arginine et la désamination subséquente du produit.Les amines biogènes sont biologiquement actives, elles sont impliquées de façon spécifique dans certaines activités cérébrales humaines, elles régulent la température corporelle, le pH stomacal, la sécrétion acide gastrique, les réactions immunitaires, la croissance et la différentiation cellulaire (Prester, 2011)
Expérience de contamination du tilapia par l’acide oxolinique
L’expérience a été réalisée en duplicata sur des tilapias mâles de 85,81 g ± 4,24 g, appartenant à la même population d’origine, nés et élevés à la ferme aquacole « Fat-Steppes ». Au laboratoire d’Aquaculture et Bioremediation (AQUABIOR) du département de Biotechnologie, de la Faculté des Sciences de la Nature et de la Vie (SNV), à l’Université d’Oran1 (Algérie), 330 tilapias ont été pesés et divisés dans quatre tanks cylindriques d’un mètre cube (1000 L) et répartis en deux lots; le premier correspondant à deux tanks de tilapias traités et le second à deux tanks de témoins. Les tilapias ont été acclimatés une semaine avant le début de l’expérimentation, dans des conditions se rapprochant autant que possible de celles rencontrées réellement en élevage aquacole. Le tank a été muni d’un équipement adéquat qui conditionne l’expérience (Figure 15) : thermoplongeur, filtres à eau et un oxygénateur. Des paramètres physicochimiques ont été contrôlés et mesurés quotidiennement. La température de l’eau a été stabilisée entre 29°C et 30°C, l’oxygène dissous entre 5 et 10 ppm et le pH à 7,6. L’entretien quotidien des tanks par siphonage, le renouvellement d’un tiers d’eau du tank et le rinçage des filtres à eau ont été réalisés chaque matin avant le nourrissage des poissons. Le dosage chimique de l’ammoniac, des nitrites et des nitrates a été réalisé tous les deux jours. La photopériode était naturelle et correspondait à 15 h d’éclairement et 9 h d’obscurité en moyenne. Les poissons des quatre tanks ont été mis à jeun deux jours avant le début de l’administration de l’aliment médicamenteux.
Extraction des résidus d’antibiotique
Le protocole de Dang et al. (2010) a été adapté pour réaliser le screening microbiologique avec une modification qui a été validée pour huit antibiotiques (Fluoroquinolones : acide oxolinique, ciprofloxacine, enrofloxacine et fluméquine & les Tétracyclines : chlortétracycline,doxycycline, tétracycline et oxytétracycline) chez le tilapia. La chair du poisson étant la seule matrice non exploitée dans les travaux de Dang et al. (2010, 2011). Pour la validation, vingt échantillons « blancs » de tilapias non contaminés, provenant du Centre de Formation et de Recherche en Aquaculture (CEFRA) de Tihange-Université de LiègeBelgique, ont été fortifiés avec chaque antibiotique d’intérêt à différentes concentrations. Dans un tube à centrifugation de 15 ml, 4 g d’échantillon (chair et peau de poisson) ont été mélangés avec 5 ml d’un mélange acétonitrile/acétone 70/30 (v/v). Après agitation 15 mn dans un agitateur rotatif et centrifugation 15 mn à 3000 rpm à 20°C, la phase supérieure a été transvasée dans un nouveau tube. L’extrait a été évaporé à sec sous courant d’azote à 40°C puis reconstitué dans 200 µl de méthanol. NB/ Le volume de méthanol a été réduit de 50 µl par rapport au protocole de base (Dang et al.,2010) afin de concentrer l’extrait et diminuer la limite de détection de la méthode. Le mélange a été vortexé, centrifugé 10 mn à 3000 rpm à 20°C. Enfin, 50 µl de la phase supérieure ont été inoculés sur chacun des deux disques en cellulose qu’on a déposé préalablement sur la gélose. Un volume supplémentaire de 20 µl NaOH à 1 % a été ajouté sur le deuxième disque..
Expérience du traitement hormonal des juvéniles de tilapias
Le protocole expérimental d’inversion sexuelle des juvéniles de tilapia du Nil (Oreochromis niloticus) à la 17Į-méthyle testostérone a été appliqué selon le protocole élaboré par le CEFRA. La première phase de fécondation a été réalisée artificiellement. 1600 œufs ont été collectés chez une femelle mature par stripping et mélangés avec la laitance d’un mâle mature dans un récipient. Une fois la fécondation activée en ajoutant de l’eau, les œufs fécondés ont été incubés dans une bouteille de Zoug (1,5 l). La température d’incubation durant l’expérience était de 27 ± 1°C jusqu’à la résorption de la vésicule vitelline au 10ème jour.Les larves obtenues (70 %) ont été ensuite pesées, dénombrées et réparties en 4 groupes de 200 individus. Les trois premiers groupes ont constitué le lot traité, ils ont été maintenus en aquariums de 50 l. Le 4ème groupe, lot témoin, a été maintenu dans une jarre cylindroconique de 50 l. Chaque système d’élevage est constitué d’un circuit fermé muni d’un filtre mécanique et biologique (vortex), d’un chauffage avec thermostat (température optimale de croissance 27°C) et d’un renouvellement constant de l’eau. La concentration en oxygène était d’un minimum de 5 ppm. Une ration optimale, de l’aliment hormoné a été distribuée entre le 10ème et le 40ème jour post-fécondation (28 jours de traitement). L’aliment du lot témoin était exempt de l’hormone.Durant ces 28 jours de traitement, la ration a été distribuée manuellement et étalée sur 8 heures (de 8 heure du matin jusqu’à 16 heure de l’après-midi). Elle a été calculée en fonction de la formule de rationnement optimale établie par le CEFRA : Y = 5,818 x-0,233 ; y : étant le poids des poissons en gramme et x : le ratio de biomasse (%).La température de l’eau et l’oxygène dissous ont été contrôlés quotidiennement avec un oxymétre. Les concentrations d’ammoniac et de nitrites dans l’eau ont été contrôlées deux fois par semaine par spectrophotomètre.Le traitement hormonal masculinisant a été appliqué par incorporation de l’hormone de synthèse (17Į-méthyle testostérone, Sigma-Aldrich, réf. 69240) dans l’alimentation des juvéniles. Afin d’incorporer l’hormone dans l’aliment, 65 mg de MT ont été dissous dans 600 ml d’éthanol absolu et mélangés avec un kilogramme d’aliment. Au total, 1,4 kg d’aliment hormoné ont été distribués durant les 28 jours de traitement correspondant à 91 mg de MT.Les alevins obtenus suite à l’inversion sexuelle ont subi un grossissement de trois mois.Les poissons ont été maintenus dans des conditions optimales d’élevage (paramètres physicochimiques et de densité d’élevage). Les alevins ont été nourris automatiquement (distributeurs d’aliment) par trois calibres de granulés dont la granulométrie dépendait de la taille du poisson.La ration distribuée correspondait à 5 % de la biomasse des poissons. Dans le respect de l’éthique animale (Autorisation n° 1123 délivrée par le comité d’éthique de l’utilisation des animaux à l’université de Liège, Belgique), les alevins sacrifiés pour le sexage et le prélèvement de la chair ont été euthanasiés à la benzocaïne (Sigma-Aldrich, réf. E1501) (200 mg l-1 d’eau).
La qualité physicochimique
Des échantillons d’eau à partir de la ferme aquacole algérienne « Fat-Steppes » (différentes prises), à partir des aquariums expérimentaux du laboratoire AQUABIOR (lors des expériences de contamination des tilapias avec l’acide oxolinique) et tout au long de l’expérience d’inversion sexuelle à la MT réalisée au CEFRA ont été contrôlés. La température, le pH et l’oxygène dissout ont été mesurés respectivement en utilisant un thermomètre à mercure, un oxy-pHmètre de type HANNA. Les nitrites, les nitrates et l’ammoniac ont été mesurés par des méthodes colorimétriques en utilisant des Kits composés de réactifs prêts à l’emploi et d’un colorimètre multiparamètres pour l’aquaculture de type HANNA (HI 83203 Multiparameter Ion Specific Meter for Aquaculture) au niveau d’AQUABIOR et de type HACH au niveau du CEFRA.
Les nitrates ont été analysés par la méthode de réduction au cadmium (réactif : HI 93728-01). C’est est une réaction en deux étapes :
=> Dans un premier temps, les nitrates sont réduits en nitrites par des ions cadmiun (cd2+).
=> Les nitrites ainsi formés sont dosés via une adaptation de la méthode de Griess. Le principe du dosage est basé sur la réaction de Griess (diazotation d’une amine primaire aromatique en présence d’un nitrite en milieu acide puis copulation avec une autre amine aromatique) :
1- Action du nitrite (NO2-) sur la sulfanilamide en milieu acide et formation d’un sel de diazonium.
2- Réaction du sel de diazonium sur le N-(1-Naphtyl) éthylènediamine (NED) en milieu chlorhydrique (pH<2). Le composé final est rose (colorant azoïque) absorbe à Ȝ =543 nm. Les nitrites ont été analysés par la meme méthode de Griess avec le réactif HI 93708-01. L’ammoniac non ionisé (NH3) a été mesuré par la méthode de Nessler (réactif : HI 93715-01). Le réactif de Nessler est un mélange, en milieu alcalin, d’iodure de potassium (KI) et d’iodure mercurique (Hg I2). En présence d’ammoniac, on obtient un composé jaune orangé. Les moisissures ont été dénombrées sur gélose glucosée au chloramphénicol après 3 à 5 jours d’incubation à 25°C.La qualité chimique de l’aliment concerne l’analyse des résidus d’acide oxolinique et des résidus de la MT dans l’aliment d’élevage par les méthodes HPLC/UV et ELISA respectivement. Les analyses de l’aliment ont été réalisées de la même façon que celles de la matrice de la chair du tilapia (méthodes préalablement expliquées en page 59 pour les résidus d’oxo et en page 66 pour la MT).
Stratégie analytique des résidus d’antibiotiques :
La présence des résidus de médicaments vétérinaires dans les denrées alimentaires d’origine animale représente un risque chimique avéré pour le consommateur. La recherche scientifique a fourni plusieurs efforts dans le développement de techniques analytiques qui permettent de déceler les résidus des antibiotiques en particulier. L’analyse quantitative de ces derniers respecte une stratégie bien planifiée qui débute par un screening, le plus souvent c’est un test microbiologique qui est non spécifique. Ce test est suivi par une confirmation spécifique par une technique enzymatique, immunologique ou chromatographique liquide. Reig & Toldra (2008) ont schématisé une procédure typique de l’analyse de résidus de médicaments vétérinaires dans la viande. Une autre stratégie avec un test post screening intermédiaire pour l’analyse des antibiotiques et des hormones dans les denrées alimentaires a été présentée par Bovee & Pikkemaat (2009). La décision de la Commission 2002/657/CE, stipule qu’un test de screening est validé lorsque sa capacité de détection (CCß) est inferieure à la valeur de LMR de l’antibiotique d’intérêt.L’interprétation des résultats est traduite selon le terme conforme pour le résultat négatif et suspect d’être non conforme pour le résultat positif. Des directives ont été élaborées afin de standardiser la méthodologie du screening des résidus de médicaments vétérinaires et un guide (4ème version) de la procédure de validation du screening a été rédigé par Gaudin & Sanders (2005). De plus, le CRL (Community Reference Laboratories Residues) a publié en 2010, des directives générales pour la validation des méthodes de dépistage de résidus des médicaments vétérinaires.Dans ce contexte, pour notre étude des résidus d’acide oxolinique (quinolone fréquemment utilisée en tilapiculture) dans la chair et le sérum du tilapia, nous avons adapté une méthodologie analytique basée sur un screening microbiologique mettant en œuvre une seule boite de gélose à pH6 ensemencée avec Bacillus subtilis et une confirmation quantitative par LC-UV-MS. Le screening d’ordre microbiologique a un grand intérêt analytique, son coût est abordable, sa mise en pratique est simple et le délai d’analyse est court. Le recours à cette méthode remonte à plusieurs décennies et les progrès accomplis ont vu varier les matrices, le nombre et la forme des géloses de culture (boites de Pétri ou ampoules), le pH des plaques, la souche bactérienne et le protocole d’extraction. En général, les souches les plus sollicitées sont : Yersinia ruckeri (Barker, 1994), E.coli (Choi et al., 1999 ; Ashwin et al., 2009 ; Sanz et al., 2010), Bacillus stearothermophilus utilisée souvent dans les ampoules pour le Premi® Test (Stead et al., 2004) ou le Delvotest® SP-NT (Stead et al., 2008), Klebsiella pneumoniae (Donoghue & Schneider, 2003 ; Schneider & Donoghue, 2004), Bacillus cereus (Okerman et al., 2007) dans l’analyse multi-résidus à 7 plaques combinée aux autres souches bactérienne et à différents pH. La souche qui a servi pour notre screening, Bacillus subtilis, a la particularité d’être sensible à plusieurs antibiotiques et surtout les fluoroquinolones et les tétracyclines (Dang et al., 2010,2011). Elle est une souche de choix pour la majorité des tests européens de référence (Belgian Kidney test, New Dutch Kidney test et EU 4-plate test).
|
Table des matières
INTRODUCTION
PREMIERE PARTIE : REVUE BIBLIOGRAPHIQUE
I. LE TILAPIA (Oreochromis niloticus)
1. Introduction
2. Position systématique
II. QUALITE DE LA CHAIR DU POISSON
1. Généralités
1.1. Structure physique
1.2. Composition chimique
a. Composés lipidiques
b. Composés protéiques
c. La fraction azotée non protéique
d. Vitamines et sels minéraux
2. Altération du poisson
2.1. Altération organoleptique
2.2. Altération biochimique
2.2.1. Autolyse et catabolisme de nucléotide
2.2.2. Oxydation des lipides
a. La lipolyse
b. La peroxydation lipidique
2.2.3. Composés volatils
2.2.4. Amines biogènes
2.3. Qualité microbiologique
III. SYSTÈME DE GESTION DE LA QUALITÉ
1. Introduction
2. Classification
a. La qualité hygiénique
b. La qualité nutritionnelle
c. La qualité organoleptique
3. Le système HACCP
IV. MEDICAMENTS VETERINAIRES
1. L’acide oxolinique
1.1. Structure
1.2. Propriétés physicochimiques
1.3. Mécanisme d’action
1.4. Pharmacocinétique chez le poisson
1.4.1. Résorption
1.4.2. Distribution
1.4.3. Biotransformation
1.4.4. Elimination
1.5. Dose et toxicité
1.6. Méthodes de contrôle des résidus d’antibiotiques chez le poisson
1.6.1. Le screening (dépistage)
1.6.2. La confirmation (quantification)
2. Hormone (17Į-méthyle testostérone)
DEUXIEME PARTIE : MATERIELS & METHODES
I. DEMARCHE HACCP
1. Evaluation des programmes préalables à L’HACCP
2. Application du système HACCP
2.1. Etapes préliminaires de l’HACCP
2.1.1. Définir le champ de l’étude
2.1.2. Caractérisation du tilapia (O. niloticus) produit à Fat-Steppes
a. Composition et caractéristiques chimiques de la chair du tilapia
b. Profil en acides gras
c. Profil en acides aminés
1) Hydrolyse acide des protéines
2) Oxydation performique avant l’hydrolyse acide
3) Dosage du tryptophane après hydrolyse alcaline des protéines
2.1.3. Etablissement du diagramme de production
2.2. Les 07 principes du système HACCP
2.2.1. Analyse des dangers (principe 1)
2.2.2. Détermination des Points critiques de Contrôle (PCC) (Principe 2)
2.2.3. Maitrise des PCCS
a) Fixation des limites critiques pour chaque PCC identifié (Principe 3)
b) Etablir un système de surveillance des CCP (Principe 4)
c) Etablir un plan d’actions correctives
d) Vérifier le système HACCP
II. EVALUATION DES DANGERS MAJEURS DE LA PHASE ANTE MORTEM
1. Méthode de détermination des résidus d’antibiotiques
1.1. Expérience de contamination du tilapia par l’acide oxolinique
1.1.1. Préparation et administration de l’antibiotique
a. L’aliment
b. Préparation de l’aliment médicamenteux
c. Administration du médicament
1.1.2. Prélèvements
a. Prélèvement sanguin
b. Prélèvement de la chair
1.2. Screening microbiologique pour la détection des résidus d’antibiotiques dans la chair du tilapia
1.2.1. Réactifs
1.2.2. Préparation des solutions
1.2.3. Préparation des milieux de culture microbiologique
1.2.4. Extraction des résidus d’antibiotiques
1.2.5. Incubation
1.2.6. Lecture
1.3. Evaluation des paramètres de performance du screening microbiologique
1.4. Analyse de confirmation par chromatographie LC-UV-MS des résidus d’acide oxolinique dans la chair de tilapia
1.4.1. Réactifs et matériels
1.4.2. Préparation des solutions
1.4.3. Extraction
1.4.4. Purification
1.4.5. Injection
1.4.6. Calcul des résultats
1.5. Evaluation des paramètres de performance de la méthode LC-UV
Justesse
Fidélité
Limite de quantification
Limite de détection
Linéarité
Spécificité
Sélectivité
2. Méthode du dosage de la 17Į-méthyle testostérone (MT)
2.1. Expérience du traitement hormonal des juvéniles de tilapias
2.2. Monitorage des résidus d’MT par ELISA
2.2.1. Préparation des solutions
2.2.2. Protocole
a. Eau
Extraction
Purification
b. Chair
Extraction
Purification
2.2.3. Procédure du test ELISA
3. Analyse microbiologique et physicochimique de l’eau d’élevage
3.1. La qualité microbiologique
3.1.1. Bactéries indicatrices
3.1.2. Bactéries pathogènes
3.2. La qualité physicochimique
4. Analyse microbiologique et chimique de l’aliment d’élevage
III. APPRECIATION DES DANGERS DE LA PHASE POST MORTEM ET EVALUATION DE LA FRAICHEUR
1. Détermination du degré d’oxydation des lipides
1.1. Extraction des lipides
1.2. Diènes conjugués
1.3. Hydroperoxydes
1.4. TBARS
2. Détermination des indices de la protéolyse
2.1. ABVT & TMA
2.2. Amines biogènes
2.2.1. Réactifs
2.2.2. Préparations des solutions
2.2.3. Protocole
a. Extraction
b. Dansylation
c. Dépôt & révélation
2.2.4. Evaluation des paramètres de performance de la méthode HPTL
3. Analyse microbiologique du tilapia
4. Analyse du pH
5. Analyse sensorielle
IV. ANALYSE STATISTIQUE
1. Analyse statistique des résultats des résidus d’acide oxolinique
2. Analyse statistique des résultats des résidus de la 17Į-MT
3. Analyse statistique des résultats des paramètres physico-chimique, organoleptique et microbiologique
TROISIEME PARTIE : RESULTATS
I. DEMARCHE HACCP
1. Evaluation des programmes préalables a L’HACCP
2. Application du système HACCP
2.1. Caractérisation du tilapia produit dans l’Ouest algérien
2.1.1. Composition et caractéristiques chimiques de la chair du tilapia
2.1.2. Profil en acides aminés
2.1.3. Profil en acides gras
2.2. Etablissement du diagramme de production
II. SURVEILLANCE DES DANGERS PENDANT LA PHASE ANTE-MORTEM
1. Résidus d’antibiotique
1.1. Adaptation d’une méthode de screening microbiologique pour la détection de résidus de fluoroquinolones
et de tétracyclines dans la chair de tilapia – mini validation
1.1.1. Contrôle de qualité du test microbiologique
1.1.2. Etude préliminaire de la capacité de détection du test microbiologique (CCȕ)
1.1.3. Optimisation de la capacité de détection du test microbiologique (CCȕ)
1.1.4. Evaluation des paramètres de performance de la méthode microbiologique
1.2. Mise au point d’une méthode de confirmation chromatographique de l’acide oxolinique par HPLC-UV
1.2.1. Optimisation de la méthode de détection LC-UV-MS
1.2.2. Evaluation des paramètres de performance de la méthode LC-UV
1.3. Analyse des échantillons de tilapia contaminés par l’acide oxolinique
1.3.1. Caractéristiques des deux lots de Tilapia contaminés par de l’acide oxolinique
1.3.2. Screening microbiologique
1.3.3. Quantification de la concentration en acide oxolinique dans la chair et le sérum du tilapia par LC-UV
1.3.4. Analyse statistique des résultats des résidus d’acide oxolinique
2. 17Į-méthyle testostérone (MT)
2.1. Paramètres physico-chimiques de l’eau
2.2. Taux de mortalité
2.3. Effet androgénique de la MT sur le sexe des tilapias (O. niloticus)
2.4. Résidus de la MT dans la chair de tilapia et à partir de l’eau rejetée
2.4.1. Optimisation du protocole d’extraction de la MT
2.4.2. Analyse des échantillons
3. Qualite microbiologique et physicochimique de l’eau et de l’aliment d’élevage
III. SURVEILLANCE DES DANGERS PENDANT LA PHASE POST MORTEM
1. Evolution temporelle de la qualité post mortem du tilapia (O. niloticus)
1.1. Qualité sensorielle
1.2. Qualité microbiologique
1.3. Evolution de la qualité biochimique de la chair de tilapia au cours de sa conservation
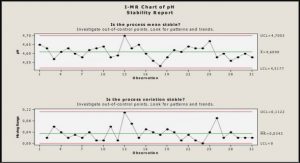
1.3.1. pH
1.3.2. Oxydation des lipides
a. Diènes conjugués
b. Hydroperoxydes & TBARS
1.3.3. Protéolyse bactérienne et enzymatique
a. ABVT & TMA-N
b. Amines biogènes
1) Paramètres de performance de la méthode
2) Dosage
2.1) Screening de six amines biogènes dans la chair de tilapia
2.2) Quantification
IV. ANALYSE & MAITRISE DES PCC (SYNTHESE)
1. Analyse des dangers et détermination des PCC de la production du tilapia à Fat-Steppes
2. Maitrise des PCC
QUATRIEME PARTIE : DISCUSSION
1. Démarche HACCP
2. Stratégie analytique des résidus d’antibiotiques
3. Evaluation des résidus de la 17Į-méthyle testostérone
4. Qualité microbiologique et chimique des aliments et des eaux d’élevage
5. Evolution temporelle de la qualité du tilapia conservé à 30°C et à 4°C
5.1. Qualité sensorielle
5.2. Qualité microbiologique
5.3. Qualité biochimique
a. pH
b. Oxydation lipidique
c. Protéolyse bactérienne et enzymatique
CINQUIÈME PARTIE : CONCLUSION GENERALE & PERSPECTIVES
REFERENCES BIBLIOGRAPHIQUES
ANNEXES
![]() Télécharger le rapport complet
Télécharger le rapport complet