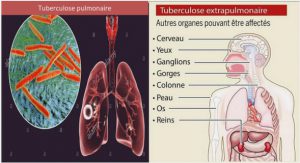
A l’heure actuelle où la malnutrition et les infections sexuellement transmissibles, notamment le SIDA, sont les principales préoccupations en matière de santé publique dans le monde entier, la tuberculose est l’une des maladies infectieuses les plus meurtrières chez les individus âgés de 15 à 50 ans qui constituent la classe la plus productive de la population. Madagascar n’est pas épargné par la tuberculose. Sa forme la plus contagieuse, la tuberculose pulmonaire à microscopie positive (TPM+) reste un fléau endémique. En 1998, le Programme National de Lutte contre la Tuberculose a constaté près de 15 000 cas de tuberculose dont plus de 10 000 cas de TPM+. Certes, dans la lutte antituberculeuse, l’objectif principal consiste à repérer précocement et à guérir efficacement les malades expectorant des bacilles tuberculeux vivants, c’est-à-dire à rompre la chaîne de transmission en agissant sur le réservoir de virus qui est presque exclusivement humain. Mais malgré les mesures intensives entreprises par les autorités gouvernementales malgaches en créant le Programme National de Lutte Antituberculeuse, la tuberculose n’a pour autant pas montré une tendance à régresser. Et à part la non-observance du traitement, le dépistage tardif des malades contagieux entrave l’éradication totale de la tuberculose. En effet, le retard du dépistage contribue à la pérennisation de la transmission de la maladie, et à l’apparition des formes graves et mortelles de la tuberculose.
DEFINITION DE LA TUBERCULOSE PULMONAIRE
La tuberculose pulmonaire se définit comme étant une maladie infectieuse transmissible des poumons, causée par un bacille découvert en 1882 par Robert KOCH, d’où son nom de « bacille de KOCH » ou BK (1). Selon l’OMS (2), un cas de tuberculose pulmonaire à frottis positif (TPM+) est:
❖soit une tuberculose pulmonaire avec des bacilles acido-alcoolo-résistants retrouvés par microscopie directe dans au moins deux échantillons d’expectoration donnés par le malade;
❖soit une tuberculose pulmonaire avec des bacilles acido-alcoolo-résistants retrouvés par microscopie dans au moins un échantillon d’expectoration donné par le malade et des anomalies radiologiques évocatrices d’une tuberculose pulmonaire;
❖soit une tuberculose pulmonaire avec des bacilles acido-alcoolo-résistants retrouvés par microscopie dans au moins un échantillon d’expectoration donné par le malade et Mycobactérium tuberculosis mis en évidence par culture sur cet échantillon.
RAPPEL HISTORIQUE DE LA TUBERCULOSE
La phtisie tuberculeuse existait à l’époque néolithique comme en témoigne la découverte de formes osseuses de tuberculose ; et l’on en trouve trace dans l’Égypte pharaonique, l’Inde antique et l’Extrême-Orient. En 1819, dans son «Traité de l’auscultation médiate», Théophile René- Marie LAENNEC a établi que la tuberculose était une maladie qui pouvait atteindre différentes parties de l’organisme (3)(4). En 1882, Robert KOCH identifia le bacille de la tuberculose (3 (5). La première tuberculine fut préparée par KOCH en 1892 et proposée comme traitement de la tuberculose. Il avait gardé secrète la composition de ce qui n’était qu’un filtrat concentré obtenu à partir de cultures en bouillon du bacille de KOCH (BK). L’utilisation de la tuberculine comme traitement fut évidemment un échec. En 1909, la tuberculine a été utilisée par injection intra-dermique (c’est le test de Charles MANTOUX) pour mettre en évidence une allergie aux bacilles tuberculeux, c’est le début des réactions cutanées tuberculiniques (RCT) d’importance capitale dans la détection de l’infection tuberculeuse .
En 1921, le médecin Albert CALMETTE et le vétérinaire Camille GUERIN ont découvert le vaccin contre la tuberculose : le vaccin BCG (Bacille de CALMETTE GUERIN) . Jusqu’aux années 1950, les traitements antituberculeux furent lourds et souvent inefficaces. La chimiothérapie antituberculeuse apparaît à la fin de la seconde Guerre mondiale. Ainsi,
•WAKSMAN et son équipe ont découvert en 1944 la streptomycine, inaugurant l’ère de la chimiothérapie antituberculeuse ;
•En 1952 fut découverte l’isoniazide ;
•En 1969, la rifampicine conféra au traitement antituberculeux son profil actuel ;
•L’ethambutol ne fut disponible en France qu’en 1970, bien que sa découverte aux ÉtatsUnis date de 1961 ;
•Le pyrazinamide a été découvert par KURSHNER en 1952.
A Madagascar, c’est vers 1900 que FONTOYNONT signalait la présence de quelques cas de tuberculose. En 1926, la vaccination par voie buccale d’un enfant Malgache fut pratiquée par ROBIC (6)(7). La lutte antituberculeuse à Madagascar a vu le jour en 1950. En 1962, le Ministère de la Santé publique et de la population, dirigé par le Docteur RAVOAHANGY Andrianavalona a mis en place une campagne de vaccination de masse par le BCG dans le but d’une bonne prévention (6)(7). En 1975, le premier projet du programme de lutte antituberculeuse a vu le jour, dont l’objectif est l’intégration de la lutte antituberculeuse dans les formations sanitaires périphériques. L’an 1991 est marqué par la réactivation du programme national de lutte contre la tuberculose, et ce n’est qu’en 1996 que le manuel du programme national de lutte contre la tuberculose a fait sa parution ainsi que les modules de formation des centres de diagnostic et de traitement (CDT) en gestion de la tuberculose .
AGENT RESPONSABLE
La tuberculose est une maladie infectieuse bactérienne due au bacille de KOCH (BK). Le bacille de KOCH est une mycobactérie. Les mycobactéries appartiennent à la famille des Mycobacteriaceae comprenant un seul genre: le genre Mycobacterium. Le genre Mycobacterium est séparé en de nombreuses espèces dont certaines ont une vitesse de croissance lente. Ces espèces appartiennent au complexe tuberculosis responsable de la tuberculose, et comprenant Mycobacterium tuberculosis hominis ou bacille de KOCH qui est la souche pathogène presque toujours responsable; et Mycobacterium tuberculosis bovis qui n’est isolé que dans 1 % des maladies tuberculeuses humaines mais avec laquelle a été préparé le BCG par atténuation. A l’opposé, on distingue les mycobactéries dites « à croissance rapide » ou mycobactéries non tuberculeuses ou atypiques. Elles sont ubiquistes, présentes en grande quantité dans l’environnement, et sont considérées comme pathogènes opportunistes. Le bacille de KOCH est un germe strictement aérobie car il a besoin d’une teneur suffisante en oxygène pour se multiplier. C’est un bacille immobile, de 2 à 5 µm de long, très sensible à la chaleur, aux rayons ultra-violets, et aux antiseptiques habituels (alcool, eau de Javel, Formol). Il résiste au froid et à la dessication. Comme toutes les mycobactéries, le BK possède l’aptitude particulière de conserver une coloration donnée malgré l’action combinée de l’alcool et de l’acide. D’où son nom de « Bacille Acido-Alcoolo-Résistant » ou « BAAR ». Cette propriété est utilisée pour mettre en évidence le bacille sur les frottis d’expectoration (bacilloscopie).
PHYSIOPATHOLOGIE DE LA TUBERCULOSE
Populations bacillaires
Au sein des lésions tuberculeuses de l’organisme, il faut distinguer trois populations bacillaires distinctes :
◆bacilles intra-cellulaires, phagocytés par les macrophages, à multiplication lente, en milieu acide ; populations de l’ordre de 10⁴ à 10⁵ bacilles ;
◆bacilles extra-cellulaires persistant dans des foyers solides mais à croissance lente, voire intermittente, en raison notamment d’une mauvaise oxygénation en pH neutre ; population estimée à 10⁴ ou 10⁵ bacilles ;
◆bacilles à multiplication active, intra-cavitaires, se développant dans le caséum ramolli à pH neutre, estimés de l’ordre de10⁸ bacilles et plus par cavernes.
L’activité des antibiotiques in vivo est très variable selon ces populations. Seule la rifampicine est active et bactéricide vis-à-vis des trois. L’isoniazide et le pyrazinamide détruisent les bacilles intra-cellulaires. La streptomycine n’est active que sur les germes à croissance rapide. L’éthambutol n’a que de propriétés bactériostatiques aux doses utilisées.
|
Table des matières
INTRODUCTION
PREMIERE PARTIE : RAPPEL DES REVUES DE LITTERATURES
I. DEFINITION DE LA TUBERCULOSE PULMONAIRE
II. RAPPEL HISTORIQUE DE LA TUBERCULOSE
III. AGENT RESPONSABLE
IV. PHYSIOPATHOLOGIE DE LA TUBERCULOSE
IV.1. Populations bacillaires
IV.2. Transmission du bacille tuberculeux
IV.3. L’infection et la maladie tuberculeuse
V. EPIDEMIOLOGIE DE LA TUBERCULOSE
V.1. Dans le monde
V.2. Dans les pays industrialisés
V.3. Dans les pays en développement
V.4. A Madagascar
VI. DIAGNOSTIC DE LA TUBERCULOSE PULMONAIRE
VI.1. Aspect clinique
VI.2. La radiographie thoracique
VI.3. L’examen bactériologique des crachats
VI.4. L’intradermoréaction (IDR)
VII. L’EVOLUTION DE LA TUBERCULOSE PULMONAIRE
VII.1. Évolution sans traitement
VII.2. Évolution sous traitement
VIII. LES PROGRAMMES DE LUTTE CONTRE LA TUBERCULOSE
VIII.1. Le programme national de lutte antituberculeuse à Madagascar
VIII.1.1. La stratégie de lutte contre la tuberculose
VIII.1.2. Les structures du programme
1) Au niveau central
2) Au niveau régional
3) Au niveau du district
4) Au niveau du CDT
5) Au niveau du CSB identifié comme centre de traitement (CT)
VIII.1.3. Le principe du traitement
VIII.1.4. Les bases du traitement
VIII.1.5. Les catégories des tuberculeux
VIII.1.6. Les schémas thérapeutiques
VIII.2. Les caractéristiques du programme national de lutte Antituberculeuse selon l’OMS et l’UICT
VIII.2.1. Le traitement D.O.T.S. (Directly Observed Treatment, Short Course)
VIII.2.2. Les schémas thérapeutiques selon l’OMS
DEUXIEME PARTIE : NOTRE ETUDE
I. OBJECTIF DE L’ETUDE
II. CADRE D’ETUDE
III. MATERIELS ET METHODE D’ETUDE
III.1. La population étudiée
III.1.1. Critères de recrutement
III.1.2. Critères d’exclusion
III.1.3. Les paramètres à évaluer
III.1.3.1. La profession des patients
III.1.3.2. Distance entre le CDT et la résidence des patients
III.1.3.3. Le niveau social
III.1.3.4. Niveau d’éducation
III.1.3.5. La perception de la maladie par les patients
III.1.3.6. La saison du début des symptômes
III.1.3.7. Les formations sanitaires proches du patient
III.1.3.8. Les attitudes du patient vis-à-vis de la maladie
III.1.3.9. Le délai de dépistage (DP)
III.1.3.10. Les moyens de déplacement
III.1.3.11. Les symptômes inauguraux
III.2. Méthodes d’analyse des données
III.2.1. Distributions de fréquence des variables
III.2.2. Mesure d’association entre les variables par le rapport des côtes
III.2.3. Le test statistique
1) Notion d’hypothèse et de risque
2) Test statistique du Khi-Carré (Khi-2 ou X²)
III.2.4. La valeur « p » ou degré de signification
III.3. La saisie informatique des données
RESULTATS
I. RESULTATS DU RECRUTEMENT
II. DESCRIPTION DES PATIENTS FINALEMENT RETENUS DANS L’ETUDE
II.1. Caractéristiques des patients selon les variables démographiques
II.1.1. Répartition des patients selon l’âge
II.1.2. Répartition des patients selon le sexe
II.1.3. Tableau récapitulatif des patients selon l’âge et le sexe
II.2. Caractéristiques des patients selon leurs catégories professionnelles et leurs niveaux socio-économiques
II.2.1. Répartition des patients selon leurs activités professionnelles
II.2.2. Répartition des patients selon le niveau social
II.3. Répartition des patients selon la distance CDT-lieu de résidence
II.4. Répartition des patients selon la formation sanitaire proche de leur lieu de résidence
II.5. Répartition des patients selon leur moyen de déplacement
II.6. Répartition des patients selon leur niveau d’instruction
II.7. Répartition des patients selon la perception de la maladie
II.8. Répartition des patients selon la saison du début des symptômes
II.9. Répartition des patients selon les signes généraux inauguraux
II.10. Répartition des patients selon les symptômes respiratoires inauguraux
II.11. Les attitudes des patients vis-à-vis de la maladie
II.11.1. L’automédication
II.11.2. La consultation médicale
II.11.3. L’hospitalisation
II.11.3.1. Les motifs de l’hospitalisation
II.11.3.2. Vision du séjour en milieu hospitalier
II.11.3.3. Mode d’admission à l’hôpital
II.12. Le délai de dépistage
II.13. L’état général de nos patients
III. LES MESURES D’ASSOCIATION DES DIFFERENTS PARAMETRES
III.1. Association entre le niveau social et l’automédication
III.2. Association entre le niveau social et le nombre de consultation médicale
III.3. Association entre le niveau social et le délai de dépistage
III.4. Association entre niveau d’instruction et automédication
III.5. Association entre le niveau d’instruction et le nombre de consultation médicale
III.6. Association entre le niveau d’instruction et le délai de dépistage
III.7. Association entre délai de dépistage et perception de la maladie
III.8. Association entre la formation sanitaire proche du patient et l’ automédication
III.9. Association entre la formation sanitaire proche du patient et la consultation médicale
III.10. Association entre formation sanitaire existante et mode d’admission à l’hôpital
III.11. Association entre formation sanitaire existante et délai de dépistage
III.12. Association entre saison du début des symptômes et délai de dépistage
III.13. Association entre l’automédication et le nombre de consultation médicale
III.14. Association entre le délai de dépistage et le mode d’admission à l’ hôpital
III.15. Association entre le délai de dépistage et la distance CDT-Domicile du patient
TROISIEME PARTIE : COMMENTAIRES ET DISCUSSIONS
I. CARACTÉRISTIQUES DES PATIENTS SELON LES VARIABLES DEMOGRAPHIQUES
I.1. L’âge des patients
I.2. Le sexe
II. LE DEBUT DE LA MALADIE
II.1. Les symptômes inauguraux
II.2. La saison du début des symptômes
III. CARACTÉRISTIQUES SOCIO-ECONOMIQUES DES PATIENTS
IV. NOS PATIENTS FACE A LA MALADIE ET LES RESSOURCES THERAPEUTIQUES A LEUR DISPOSITION
IV.1. La perception de la maladie
IV.2. L’automédication
IV.3. Les consultations dans les centres sanitaire
IV.4. L’hôpital et le patient
V. LE DELAI DE DEPISTAGE
SUGGESTIONS ET CONCLUSIONS SUGGESTIONS
I. L’Information-Education-Communication
II. Lutte contre la pauvreté
III. Création des CDT
IV. Formation des personnels de santé qualifiés
CONCLUSION
ANNEXES
BIBLIOGRAPHIE